
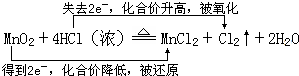
���� MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$Cl2��+MnCl2+2H2O�У�MnԪ�صĻ��ϼ۽��ͣ�ClԪ�صĻ��ϼ����ߣ��÷�Ӧת��2e-���Դ������
��� �⣺��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$Cl2��+MnCl2+2H2O�У�MnԪ�صĻ��ϼ۽��ͣ�ClԪ�صĻ��ϼ����ߣ��÷�Ӧת��2e-��˫���ű�ʾ������������ԭ��Ӧ�ı仯Ϊ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��n��MnO2��=$\frac{87g}{87g/mol}$=1mol���ɷ�Ӧ��֪��������Ϊ1mol����״���£��ռ��������������Ϊ1mol��22.4L/mol=22.4L���ʴ�Ϊ��22.4��
����4molHCl��ȫ��Ӧ����1mol���������淴Ӧ���У�Ũ�����Ϊϡ���ᣬ�������������٣������������22.4L���ʴ�Ϊ������
���� ���⿼��������ԭ��Ӧ�����㣬Ϊ��Ƶ���㣬���շ�Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ������ط�����Ӧ�ÿ��飬ע��Ԫ�ػ��ϼ��жϣ���Ŀ�ѶȲ���


 �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu | B�� | C | C�� | Na2CO3 | D�� | SiO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3.65g | B�� | 7.3g | C�� | 10.95g | D�� | 14.6g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4��1��5��NO2 | B�� | 4��2��4��NO2 | C�� | 4��1��3��NH4NO3 | D�� | 4��3��5��NO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
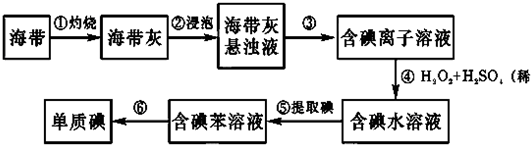
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
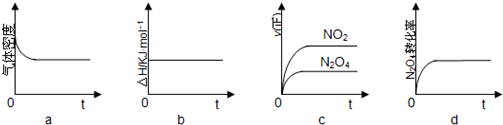
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
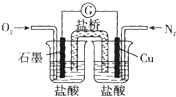
| A�� | ʯī�ĵ缫��Ӧ��O2+2H20+4e-�T4OH- | |
| B�� | ��װ���ܽ���ѧ��ת��Ϊ���� | |
| C�� | ������Cu�缫����������ʯī�缫 | |
| D�� | ����ܷ�Ӧ��2Cu+O2+4HCl�T2CuCl2+2H20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�11.2 L���������ķ�����ΪNA | |
| B�� | 1.8 g ��NH4+�к��еĵ�����ΪNA | |
| C�� | ���³�ѹ�£�48 g O3���е���ԭ����ΪNA | |
| D�� | 24 g����þ��Ϊþ����ʱʧȥ�ĵ�����ΪNA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com