
分析 A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大,A原子核外有三个未成对电子,其电子排布式为1S22S22P3,为N元素,元素B的氢化物能用于刻蚀玻璃,则B为F元素,C元素是地壳中含量最高的金属元素,则C为Al元素,D原子核外的M层中只有两对成对电子,电子排布式为1S22S22P63S23P4,应为S元素,E原子核外最外层只有1个电子,其余各层电子均充满,原子序数大于硫,则E的电子排布式为1S22S22P63S23P63d104S1,所以E为Cu元素,据此答题;
解答 解:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大,A原子核外有三个未成对电子,其电子排布式为1S22S22P3,为N元素,元素B的氢化物能用于刻蚀玻璃,则B为F元素,C元素是地壳中含量最高的金属元素,则C为Al元素,D原子核外的M层中只有两对成对电子,电子排布式为1S22S22P63S23P4,应为S元素,E原子核外最外层只有1个电子,其余各层电子均充满,原子序数大于硫,则E的电子排布式为1S22S22P63S23P63d104S1,所以E为Cu元素,
(1)根据上面的分析可知,E为Cu元素,E的核外电子排布式是1s22s22p63s23p63d104s1(或[Ar]3d104s1),在元素周期表中,同一周期元素的第一电离能从左到右逐渐增大,同一主族元素的第一电离能从上到下逐渐减小,据此可判断四种元素的第一电离能的顺序为:Al<S<N<F,
故答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1);Al<S<N<F;
(2)化合物CA为AlN,C的氯化物为AlCl3,AlN为原子晶体而AlCl3为分子晶体,所以AlN的熔点远高于AlCl3的熔点,
故答案为:AlN为原子晶体而AlCl3为分子晶体;
(3)A的最高价含氧酸根离子为NO3-,NO3-中氮原子的价层电子对数为$\frac{5+1}{2}$=3,所以氮原子采取sp2杂化,D的低价氧化物为SO2,由于分子中硫原子的价层电子对数为$\frac{6}{2}$=3,分子中有一对孤电子对,所以分子的空间构型是V形,
故答案为:sp2;V形;
(4)F2与NaOH溶液反应的产物之一是OF2,该反应的离子方程式为2F2+2OH-=OF2+2F-+H2O,
故答案为:2F2+2OH-=OF2+2F-+H2O.
点评 本题考查元素推断题,推断出元素的种类是解答本题的关键,推断时注意从原子的核外电子排布特点以及元素的特殊性质为突破口解答,本题具有一定难度.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题

| A. | 一段时间后,铜棒上有红色物质析出 | |
| B. | 正极反应为:Zn-2e-═Zn2+ | |
| C. | 在外电路中,电流从负极流向正极 | |
| D. | 盐桥中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图中X、Y分别是直流电源的两极,通电后发现a极板的质量增加,b极板上有无色无味的气体产生.下列符合此现象的是( )
如图中X、Y分别是直流电源的两极,通电后发现a极板的质量增加,b极板上有无色无味的气体产生.下列符合此现象的是( )| a极板 | b极板 | Y电极 | c溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 石墨 | 石墨 | 负极 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
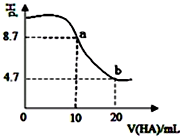 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | HA为强酸 | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | b点所示溶液中c(A-)>c(HA) | |
| D. | pH=7时,c(Na+)=c(A-)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com