
| A. | 最高正化合价:F>O>N>C>Al | B. | 离子半径:F->O2->Na+>Al3+ | ||
| C. | 热稳定性:PH3<H2S<HCl<HF | D. | 碱性强弱:NaOH>Mg(OH)2>Al(OH)3>KOH |
分析 A.O、F元素非金属性很强,没有正化合价;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.元素非金属性越强,其氢化物的稳定性越强;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强.
解答 解:A.O、F元素非金属性很强,没有正化合价,故A错误;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小,则:O2->F->Na+>Al3+,故B错误;
C.元素非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>S>P,则热稳定性:PH3<H2S<HCl<HF,故C正确;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性K>Na>Mg>Al,则碱性KOH>NaOH>Mg(OH)2>Al(OH)3,故D错误;
故选C.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素原子结构、元素性质关系是解本题关键,知道非金属性、金属性强弱判断方法,注意规律中的反常现象,易错选项是A.


科目:高中化学 来源: 题型:解答题
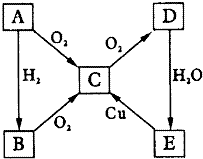 如图所示转化关系,A为单质,试对下列情况进行推断,并回答下列问题:
如图所示转化关系,A为单质,试对下列情况进行推断,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 操作 | 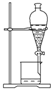 | 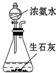 | 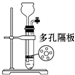 | 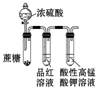 |
| 实验 目的 | 分离乙酸与乙酸乙酯的混合液 | 制取氨气 | 盐酸与碳酸钙反应,验证碳与氯的非金属性强弱 | 验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
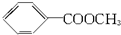
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Z>Y>W | B. | Z>W>X>Y | C. | Z>X>Y>W | D. | Z>Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | Z的最高价氧化物对应水化物与其氢化物能发生化合反应生成离子化合物 | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 相同条件下,X、Y的单质分别与盐酸反应时,后者反应剧烈些 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com