
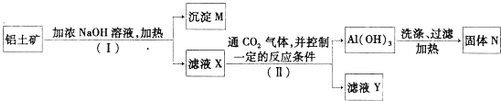
分析 Fe2O3和氢氧化钠不反应,而氧化铝、二氧化硅能反应,步骤I利用过滤除去Fe2O3,沉淀M为氧化铁等不溶物,溶液X含有偏铝酸钠、硅酸钠,步骤II通入二氧化碳,控制条件使铝离子转化为氢氧化铝沉淀,过滤得氢氧化铝,加热分解氢氧化铝得到氧化铝,滤液Y含有硅酸盐、碳酸盐.
(1)分离固体与溶液的方法为过滤;
(2)由工艺流程可知,M为Fe2O3,N为Al2O3;
(3)溶液X含有偏铝酸钠,属于盐;
(4)氢氧化铝溶于强碱,实验室通常用弱碱氨水与铝盐制备氢氧化铝沉淀,氨水与氯化铝反应生成氢氧化铝与氯化铵;
(5)由流程可知滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有硅酸钠.
解答 解:Fe2O3和氢氧化钠不反应,而氧化铝、二氧化硅能反应,步骤I利用过滤除去Fe2O3,沉淀M为氧化铁等不溶物,溶液X含有偏铝酸钠、硅酸钠,步骤II通入二氧化碳,控制条件使铝离子转化为氢氧化铝沉淀,过滤得氢氧化铝,加热分解氢氧化铝得到氧化铝,滤液Y含有硅酸盐、碳酸盐.
(1)I和II步骤分离固体与溶液的方法为过滤;
故答案为:过滤;
(2)由工艺流程可知,M为Fe2O3,N为Al2O3,由氢氧化铝加热分解生成,方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Fe2O3,2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(3)由工艺流程可知,滤液X中,含铝元素的溶质的化学式为:NaAlO2,属于盐,
故答案为:NaAlO2;盐;Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O;
(4)氢氧化铝溶于强碱,实验室通常用弱碱氨水与铝盐制备氢氧化铝沉淀,氨水与氯化铝反应生成氢氧化铝与氯化铵,反应方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
故答案为:氨水;Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(5)溶液X含有偏铝酸钠、硅酸钠,步骤II通入二氧化碳,控制条件使铝离子转化为氢氧化铝沉淀,过滤得氢氧化铝,则滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有硅酸钠,故答案为:硅酸钠(或Na2SiO3).
点评 本题以工艺流程题形式考查铝的化合物的性质、物质的分离提纯、处于化学用语书写等,为高频考点和常见题型,侧重于学生的分析能力和实验能力的考查,题目有利于培养学生良好的科学素养,难度中等,清楚工艺流程原理是关键,是对知识迁移的综合运用.


科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③ | C. | ③④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
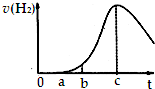 把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )| A. | 曲线由0→a段发生了氧化还原反应 | |
| B. | 曲线由b→c段,产生氢气的速率增加较快的主要原因是反应放热 | |
| C. | c点达到了平衡 | |
| D. | c点以后,反应逐渐消耗了产生的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | 溶液BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| A | NaHCO3溶液 | Na2CO3 | Ba(OH)2溶液 |
| B | Fe2O3 | Al2O3 | NaOH溶液 |
| C | FeCl3溶液 | CuCl2 | Fe |
| D | Na2SO4溶液 | Na2CO3 | 盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体、BaSO4 | B. | 铜、二氧化硫 | ||
| C. | NaOH固体、CO2 | D. | 熔融的KNO3、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液 | 加入的物质 | 答案序号 |
| AlCl3溶液 | 通入过量的NH3 | ① |
| 含少量NaOH的NaAlO2溶液 | 通过量的CO2 | ② |
| NaAlO2溶液 | 滴加稀H2SO4至过量 | ③ |
| MgCl2和AlCl3的混合液 | 滴加NaOH溶液至过量 | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中C、H、O的原子个数之比一定为1:4:4 | |
| B. | 一定为烃类 | |
| C. | 分子中一定含有氧原子 | |
| D. | 分子式为CH4Ox(x=0、1) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com