
 合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用.分析 (1)根据H原子守恒计算计算z的值;
由吸氢速率单位可知,为单位时间内单位质量金属吸收氢气体积;
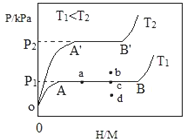
由图可知,氢原子与金属原子的个数比相同时,T2温度高,对应的平衡时氢气的压强大,说明升高温度,平衡逆向移动;
(2)T2温度高,对应的平衡时氢气的压强大,则升高温度,平衡逆向移动,则该反应为放热反应,低温下有利于吸收氢;
当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,因温度不变,K不变,则平衡时氢原子与金属原子的个数比增大,平衡点在曲线AB上;
释放氢气即为平衡逆向移动,结合该反应为放热反应、气体体积减小的反应特点解答;
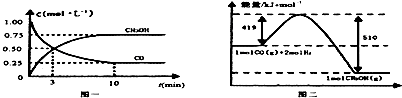
(3)已知:①CH4(g)+2H2O═CO2(g)+4H2(g)△H=+165kJ•mol-1
②CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1,
根据盖斯定律,②-①可得:CO(g)+3H2(g)═CH4(g)+H2O(g).
解答 解:(1);zMHx(s)+H2(g)?zMHy(s)中遵循质量守恒定律,则反应前后H原子个数相同,则zx+2=zy,解得z=$\frac{2}{y-x}$;
由吸氢速率单位可知,为单位时间内单位质量金属吸收氢气体积,故吸氢速率v=$\frac{\frac{240mL}{2g}}{4min}$=30mL•g-1•min-1;
由图可知,氢原子与金属原子的个数比相同时,T2温度高,对应的平衡时氢气的压强大,说明升高温度反应向生成氢气的方向移动,即升高温度向逆方向移动,则逆方向为吸热反应,所以正方向为放热反应,即△H1<0,
故答案为:$\frac{2}{y-x}$;30;<;
(2)T2温度高,对应的平衡时氢气的压强大,则升高温度,平衡逆向移动,则该反应为放热反应,低温下有利于吸收氢,T1<T2时,则η(T1)>η(T2);
当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,因温度不变,K不变,平衡时氢原子与金属原子的个数比增大,平衡点在曲线AB上,则达到平衡后反应(Ⅰ)可能处于图中的c点;
释放氢气即为平衡逆向移动,因该反应为放热反应、气体体积减小的反应,则该贮氢合金可通过加热或减压的方式释放氢气;
故答案为:>;c;加热;减压;
(3)已知:①CH4(g)+2H2O═CO2(g)+4H2(g)△H=+165kJ•mol-1
②CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1,
根据盖斯定律,②-①可得:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ•mol-1 ,
故答案为:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ•mol-1 .
点评 本题考查化学平衡图象、反应速率、盖斯定律应用等,把握平衡移动的影响因素、图象中纵横坐标的含义为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2S和Na2O2的固体混合物中含有的阴离子数目为0.1NA | |
| B. | 用铜做电极电解CuSO4溶液的反应方程式:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 等质量的N2和CO所含原子数均为2NA | |
| D. | pH等于2的醋酸溶液中加入0.01mol/L的盐酸,溶液pH会变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | |
| B. | 2Na2O2+2CO2═2NaCO3+O2 | |
| C. | Na2O2+H2SO4(稀)═Na2SO4+H2O2 | |
| D. | Fe2O3+3Na2O2(熔融)═2Na2FeO4十Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学是在原子、分子水平上研究物质的组成、结构、性质、制备等的自然科学 | |
| B. | 化学是一门具有创造性的科学,可以利用化学知识创造出自然界中不存在的物质 | |
| C. | 化学的发展经过了从宏观到微观,从感性到理性的逐步深化的过程 | |
| D. | 随着化学的发展,人们最终会实现通过化学变化使水变油的梦想 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH${\;}_{4}^{+}$+Al3++2SO${\;}_{4}^{2-}$+2Ba2++5OH-═AlO+2BaSO4↓+NH3•H2O+2H2O | |
| B. | 工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2═Ca2++ClO-+Cl-+H2O | |
| C. | 制备Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数也可以是小数 | |
| C. | 1molH2SO4和1mo Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 | |
| D. | 1molH2和0.5mol O2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=5的NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| B. | 在0.1mol•L-1的CH3COONa溶液中:n(OH-)+0.1mol>n(CH3COOH)+n(H+)+n(Na+) | |
| C. | 向AgBr的饱和溶液中加入NaCl固体,有白色固体析出,说明AgCl比AgBr更难溶 | |
| D. | 10mL0.1mol•L-1H2SO4与10mL 0.01mol•L-1NaOH溶液充分混合,若混合后的体积为20mL,则溶液的pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com