
| A. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3 NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
分析 A.3mol二氧化氮与水反应生成2mol硝酸,转移了2mol电子;
B.0℃,101kPa为标准状况下,标准状况下22.4L氢气的物质的量为1mol,含有2mol氢原子;
C.根据n=$\frac{m}{M}$计算出二氧化硫的物质的量,然后计算出含有原子的物质的量;
D.NA个一氧化碳分子的物质的量为1mol,根据m=nM计算出二者的质量之比.
解答 解:A.3mol NO2与足量H2O反应生成1molNO和2mol硝酸,转移了2mol电子,转移的电子数为2NA,故A错误;
B.在0℃,101kPa时,22.4 L氢气的物质的量为1mol,1mol氢气分子中含有2mol氢原子,含有2NA个氢原子,故B错误;
C.64g二氧化硫的物质的量为:$\frac{64g}{64g/mol}$=1mol,1mol中含有3mol原子,含有的原子数为3 NA,故C正确;
D.NA个一氧化碳分子的物质的量为1mol,其质量为:28g/mol×1mol=28g,0.5mol甲烷的质量为:16g/mol×0.5mol=8g,则二者质量之比为28g:8g=7:2,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生灵活运用基础知识解决实际问题的能力.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:解答题
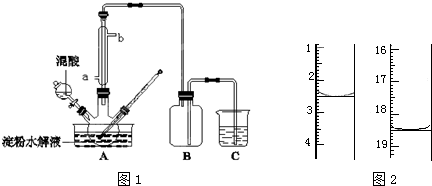
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
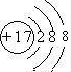 .
.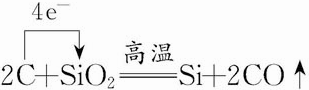 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
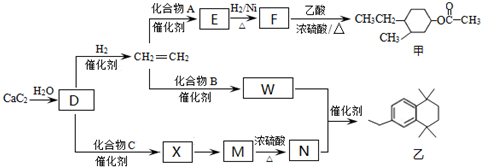
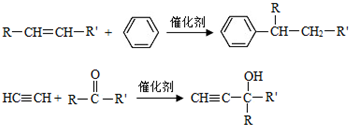 (-R、-R′代表烃基或-H)
(-R、-R′代表烃基或-H)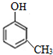 ,“E→F”的反应类型为加成反应.
,“E→F”的反应类型为加成反应.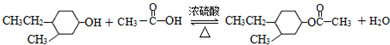 .
.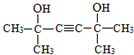 .
.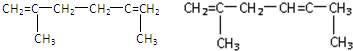 .
.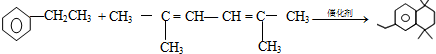 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- | |
| B. | 常温下,NaHCO3溶液显碱性:HCO3-+H2O?CO32-+H3O+ | |
| C. | 氢氧化镁与稀硫酸反应:H++OH-═H2O | |
| D. | 硫酸亚铁酸性溶液中加入过氧化氢:Fe2++H2O2+2H+═Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是否是大量分子或离子的集合体 | B. | 分散质粒子的大小 | ||
| C. | 是否能通过滤纸 | D. | 是否有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯30°C时即可发生硝化反应,比苯的硝化容易,是由于甲基对苯环的影响 | |
| B. | 苯不能被酸性高锰酸钾溶液氧化而甲苯可以,是由于甲基对苯环的影响 | |
| C. | 苯酚可以与浓溴水发生取代反应,比苯的溴代容易,是由于羟基对苯环的影响 | |
| D. | 由于苯环和取代基的相互影响导致二者的性质均有变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com