
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| | W | X | Y | Z |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |

(1)ⅣA (2)Na (3)①C D ②电子层数相同,质子数Y > X
(4)HN3+NaOH=NaN3+H2O (5)A B C
解析试题分析:根据题意可推出W是N;X是Na;Y是Al ; Z 是Si 。(1)Si核外电子排布为2、8、4。所以它在元素周期表中位于第三周期第ⅣA。(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,这种物质是NaOH。则该元素是Na。(3)①Na、Al都是金属元素,可以通过其单质与水反应置换出氢的难易程度比较;也可以通过比较最高价氧化物对应水化物的碱性强弱。但不能看其原子失去电子的多少或自然界中的含量的多少。。因此选项为CD。②Na、Al都是第三周期的元素,原子核外的电子层数相同,但由于质数Al>Na。原子序数越大,原子半径就越小,原子失去电子就越难,元素的金属性就越弱。所以金属性Na >Al。(4)HN3酸性与醋酸相似,则它是弱酸。酸碱中和生成盐和水。则HN3与NaOH反应的方程式为HN3+NaOH=NaN3+H2O。(5) 有关反应的方程式为Mg+H2SO4=MgSO4+H2↑; 2Al+ 3H2SO4= Al2(SO4)3+ 3H2↑;当加足量的NaOH溶液时发生反应:AlCl3+4NaOH= NaAlO2+3NaCl+2H2O; MgSO4+2NaOH= Mg(OH)2↓+Na2SO4。得到的沉淀是Mg(OH)2.将其过滤、洗涤、干燥后灼烧发生分解反应得到MgO。Mg(OH)2 MgO+H2O。A.根据MgO的质量n可计算出其中的Mg元素的质量,再用Mg、Al的总质量减去Mg元素的质量即得到Al的质量,从而求出Al的质量分数。正确。B.假设Mg、Al的物质的量分别为a、b。则根据题意可得24a+27b=m;a+3/2b=y.两式联立就可计算出Al的物质的量,进而得出Al的质量,从而求出Al的质量分数。正确。C.根据MgO的质量n可计算出其中的Mg元素的质量,利用n=m/M计算出Mg的物质的量。根据Mg+H2SO4=MgSO4+H2↑知道其放出H2的物质的量。再用n(H2)(Al)=n(H2)(总)- n(H2)(Mg).根据2Al+ 3H2SO4= Al2(SO4)3+ 3H2↑可求出Al的物质的量,进而得出Al的质量,从而求出Al的质量分数。正确。
MgO+H2O。A.根据MgO的质量n可计算出其中的Mg元素的质量,再用Mg、Al的总质量减去Mg元素的质量即得到Al的质量,从而求出Al的质量分数。正确。B.假设Mg、Al的物质的量分别为a、b。则根据题意可得24a+27b=m;a+3/2b=y.两式联立就可计算出Al的物质的量,进而得出Al的质量,从而求出Al的质量分数。正确。C.根据MgO的质量n可计算出其中的Mg元素的质量,利用n=m/M计算出Mg的物质的量。根据Mg+H2SO4=MgSO4+H2↑知道其放出H2的物质的量。再用n(H2)(Al)=n(H2)(总)- n(H2)(Mg).根据2Al+ 3H2SO4= Al2(SO4)3+ 3H2↑可求出Al的物质的量,进而得出Al的质量,从而求出Al的质量分数。正确。
考点:考查元素的推断、元素在周期表中的位置、元素的金属性的比较、化学方程式的书写及混合物中某成分的质量分数的计算的知识。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:填空题
(15分)开发新型储氢材料是氢能利用的重要研究方向。
(1)化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。请回答:
①H3BNH3中是否存在配位键 (填“是”或“否”),B、C、N、O第一电离能由大到小的顺序为 ,CH4、H2O、CO2三分子按照键角由大到小的顺序排列为 。
②与(HB=NH)3互为等电子体的分子为 (填分子式)
③人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷。工业上可采用LiAlH4和BCl3在一定条件下制备乙硼烷B2H6,该反应的化学方程式为 。
④在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式。图a为一种无限长链状结构的多硼酸根,其化学式为 ,图b为硼砂晶体中阴离子,其中硼原子采取的杂化方式为 。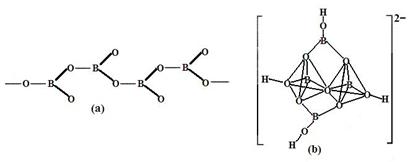
(2)一种铜合金具有储氢功能
①Cu2+的价层电子排布式为 。
②铜及其它许多金属及其化合物都可以发生焰色反应,其原因是 。
③铜的单质中按ABCABC……方式堆积,设铜原子半径为a pm,则该晶体的密度为 g/cm3(阿伏伽德罗常数值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有V、W、X、Y、Z五种元素,它们的核电荷数依次增大;且都小于20。其中只有X、Z是金属元素;V、Z元素原子最外层都只有一个电子;W、Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半.由此推知:
V是 、W是 、X是 、Y是 、Z是 (填元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A是有机羧酸盐,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,其中B的碱性最强。X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同。A与B等物质的量反应生成D和一种气体单质;C受热分解得到Y、D和X;B与C反应生成D和X。E由两种元素组成,式量为83,将E投入X中得到B和气体Z,Z在标准状况下的密度为0.76g·L-1。
(1)A的化学式是 。Y的电子式是 。
(2)X的沸点比同主族同类型物质要高,原因是 。
(3)写出E与足量盐酸反应的化学方程式
(4)写出在D的饱和溶液中不断通Y析出C的离子方程式 。
(5)A的一个重要应用是根据2A →P +H2↑得到P,P溶液中的阴离子通常用CaCl2使之沉淀,当它完全沉淀时,溶液中Ca2+的物质的量浓度至少为 。
(沉淀Ksp=2.3×10-9,当溶液中离子浓度≤10-5mol·L-1,即可认为完全沉淀)
(6)实验室常用P与足量HCl反应所得的有机物在浓硫酸条件下共热分解制某还原性气体,设计实验证明分解产物中还原性气体的存在 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知X元素原子的K、L层的电子数之和比L、M层的电子数之和多1个电子。Y元
素的原子最外层电子数比内层电子数少3个。Z元素核外有3个电子层,最外层有3个电子。W元素最高化合价是最低化合价绝对值的3倍,它在最高价氧化物中的质量分数为40%。
(1)Y和W的气态氢化物的稳定性为(用化学式表示) > 。
(2)X单质在空气中加热生成的化合物是 化合物(填“离子”或“共价”)。
(3)X和Z的最高价氧化物对应水化物反应的离子方程式 。
(4)W的低价氧化物与Y单质的水溶液反应的化学方程式 。
(5)Y与Z形成化合物的化学式是 。实验测得当此化合物处于固态和液态时不导电,溶于水能导电。由此判断该化合物具有 键(填“离子”或“共价”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程: 。
(3)写出A、B两元素最高价氧化物的水化物反应的离子方程式: 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种元素,它们原子的核电荷数均小于18,且依次递增。A原子核内仅有1个质子,B原子的电子总数与D原子的最外层电子数相等,A原子与B原子的最外层电子数之和与C原子的最外层电子数相等,D原子的最外层电子数是次外层电子数的3倍。试推断它们各是什么元素,并写出其元素名称与符号。
A ;B ;C ;D 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)图1为元素X的前五级电离能的数值示意图。已知X的原子序数<20,请写出X基态原子的核外电子排布式 。
(2)A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图2所示。
请回答:
①上述元素中,某些元素的常见单质所形成的晶体为分子晶体,这些单质分子中既含有σ键又含有π键的是 (填化学式)。
②已知D、F、G三种元素的离子具有跟E相同的电子层结构,则B、C、D三种元素的第一电离能由大到小的顺序为(用相关元素符号表示) 。
③已知H的电负性为1.5,而氯元素的电负性为3.0,二者形成的化合物极易水解,且易升华。据此推测该化合物的化学键类型为 。
④原子序数比A小1的元素与D元素形成的化合物的空间构型为 ,中心原子的杂化方式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大。
②E元素的电离能数据见下表(kJ·mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4 562 | 6 912 | 9 540 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com