
| A. | 碳酸氢钠可用于治疗胃酸过多 | |
| B. | 用氯化钡溶液可鉴别SO42-和CO32- | |
| C. | CO、NO、NO2都是大气污染物 | |
| D. | 常温下,可用铝制或铁制槽车运输浓硫酸 |
分析 A.碳酸氢钠碱性弱,能够与盐酸反应;
B.依据硫酸钡、碳酸钡都是沉淀解答;
C.有毒物质都能污染空气;
D.依据浓硫酸的强氧化性解答.
解答 解:A.碳酸氢钠碱性弱,能够与盐酸反应,消耗盐酸,可以用来治疗为胃酸过多,故A正确;
B.硫酸钡、碳酸钡都是白色沉淀,二者现象相同,所以不能用用氯化钡溶液可鉴别SO42-和CO32-,故B错误;
C.CO、NO、NO2都是有毒气体,都是大气污染物,故C正确;
D.浓硫酸具有强的氧化性,常温下能够使铝、铁钝化,所以可用铝制或铁制槽车运输浓硫酸,故D正确;
故选:B.
点评 本题考查了元素化合物知识,明确相关物质的性质是解题关键,注意离子检验应依据特征反应,排除杂质离子干扰,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸显弱酸性,可用于雕刻玻璃 | |
| B. | NaClO溶液显碱性,可用于杀菌消毒 | |
| C. | NH4Cl分解时吸收大量的热,可用作阻燃剂 | |
| D. | CO2密度比空气大,可用作镁着火时的灭火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热反应可以快速制取单质铁,工业上常用此法冶炼铁 | |
| B. | NaHCO3能与碱反应,食品工业中用做焙制糕点的膨松剂 | |
| C. | K2FeO4具有强氧化性,其产物水解生成Fe(OH)3胶体,故可用于自来水消毒和净化 | |
| D. | SO2具有漂白性,可用于食品的消毒和漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L由O2、和NO2组成的混合气体含有的原子数为2NA | |
| B. | 1mol羟基与1mol氢氧根离子含有的电子数均为9NA | |
| C. | 0.1molFe2+与足量H2O2溶液反应,转移的电子数为0.1NA | |
| D. | 1L1 mol•L-1NaF溶液中含有F-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发和推广新能源是实现低碳生活的唯一途径 | |
| B. | 化学药品NaH着火,不能用水或泡沫灭火器灭火 | |
| C. | 食品添加剂虽能改变食物味道等,但需限量使用 | |
| D. | 化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
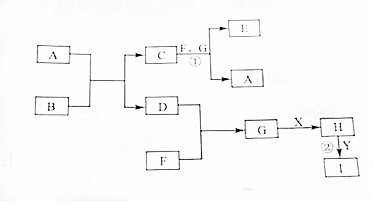 有关物质的转化关系如图所示(部分物质与条件已略去).其中A,D,F,G为常见的气体,D为单质,A,F,G为氧化物,G为棕红色;B为淡黄色固体.X是最常见的液体,Y是常见的金属单质,I溶液为蓝色,
有关物质的转化关系如图所示(部分物质与条件已略去).其中A,D,F,G为常见的气体,D为单质,A,F,G为氧化物,G为棕红色;B为淡黄色固体.X是最常见的液体,Y是常见的金属单质,I溶液为蓝色, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1=△H2=△H3 | B. | △H2<△H1<△H3 | C. | △H2=△H3>△H1 | D. | △H2=△H3<△H1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com