
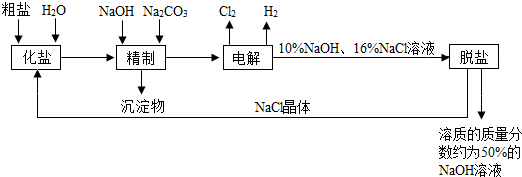
分析 粗盐中加入水化盐得到盐水,向粗盐水中加入NaOH、碳酸钠,除去Mg 2+、Ca2+,得到Mg(OH)2、CaCO3沉淀,将精制的食盐水电解,发生反应2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,然后脱盐得到NaOH浓溶液,将得到的NaCl晶体循环利用,
(1)电解饱和食盐水时,与电源负极相连的为阴极,阴极上氢离子放电生成氢气;与电源正极相连为阳极,生成氯气,氯气用湿润的淀粉碘化钾试纸检验;
(2)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀;
(3)除杂时要除去杂质其不能引进新的杂质,或阴极新的杂质在后续操作中除去;
(4)除杂注意不能引入新的杂质,有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(5)从溶液中得到晶体,采用蒸发浓缩、冷却结晶、过滤的方法;
(6)电解饱和食盐水的反应生成NaOH、氢气和氯气;
(7)Cl2和NaOH溶液反应生成NaCl和次氯酸钠.
解答 解:(1)电解饱和食盐水的反应:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,与电源负极相连的为阴极,得电子生成氢气,电极反应为2H++2e-=H2↑,与电源正极相连为阳极,生成氯气,检验氯气用淀粉KI溶液,
故答案为:2H++2e-=H2↑;淀粉KI溶液;
(2)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀,离子反应分别为Ca2++CO32-=CaCO3、Mg2++2OH-=Mg(OH)2↓,
故答案为:Ca2++CO32-=CaCO3;Mg2++2OH-=Mg(OH)2↓;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以该钡试剂不能选用,选ac;
(4)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3 溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3 溶液,最后加入盐酸,所以加入试剂合理的顺序为bc,
故答案为:bc;
(5)氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,所以氢氧化钠和氯化钠分离的方法是:通过加热蒸发结晶、冷却、过滤除去NaCl,
故答案为:过滤;
(6)电解饱和食盐水的反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
(7)Cl2和NaOH溶液反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查物质制备及物质分离和提纯,为高频考点,涉及离子方程式和化学方程式的书写、除杂、物质分离和提纯等知识点,明确化学反应原理及物质性质差异性是解本题关键,注意操作或滴加试剂先后顺序对实验的影响,为易错点.


科目:高中化学 来源: 题型:填空题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.
已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.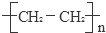 ,反应类型:加聚反应.
,反应类型:加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
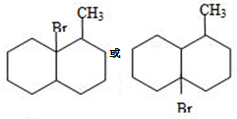
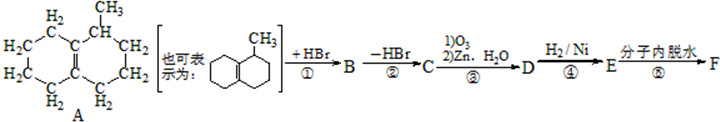 该小组经过上述反应.最终得到F1(
该小组经过上述反应.最终得到F1( )外,还得到它的同分异构体,其中BCDEF分别代表一种或多种物质.
)外,还得到它的同分异构体,其中BCDEF分别代表一种或多种物质.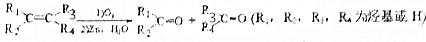
 .
. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
| A. | T1<T2 | |
| B. | K2=1.35 mol•L-1(或K2=1.35) | |
| C. | 混合气体的密度始终保持不变 | |
| D. | 乙容器中,当反应进行到1.5 min时,n(H2O)=1.4 mol. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMn04溶液鉴别乙烯和乙炔 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 苯和硝基苯采用分液的方法分离 | |
| D. | 分离沸点相差30℃以上的混溶液体,采用蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com