
| 56g×0.08mol |
| 1mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.02 | 20.00 |
| 2 | 0.10 | 20.00 | 20.00 |
| 3 | 0.10 | 19.00 | 20.00 |
| 4 | 0.10 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
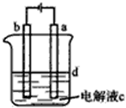
| A、a电极发生的电极反应:4OH--4e-=O2↑+2H2O |
| B、为了在较短时间内看到白色沉淀,可适当加大电压 |
| C、c可以是氯化钠溶液,d可以是苯 |
| D、为了在较短时间内看到白色沉淀,可以剧烈地搅拌溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、①② |
| C、①②③ | D、都有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)用l体积SO2和3体积空气混合,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)?2SO3(g).一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为
(1)用l体积SO2和3体积空气混合,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)?2SO3(g).一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度(g/100g水) | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.3 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | |||||||||
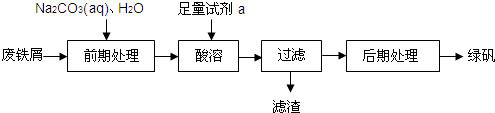
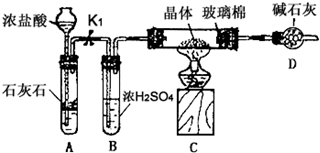

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com