
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
 2Z,根据平衡常数等于生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比,得K=
2Z,根据平衡常数等于生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比,得K=(
| ||||
(
|


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、已知25℃时,有关弱酸的电离平衡常数:HCN Ka=4.9×10-10; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11.则将少量CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2═2HCN+Na2CO3 |
| B、将pH=6的H2SO4稀释1000倍后,c(H+)=200c(SO42-) |
| C、已知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液的浓度为 5.6×10-5 mol/L,则生成沉淀所需Na2CO3溶液的最小浓度为5×10-5mol/L |
D、 在不同条件下进行的异构化反应X?Y的进程图解如图所示.图中的“  ”是X,“ ”是X,“ ”是Y,则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小 ”是Y,则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
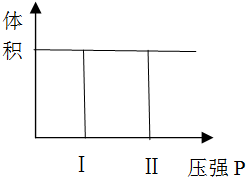

| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |

查看答案和解析>>
科目:高中化学 来源: 题型:
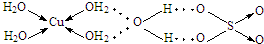
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:A、B、C、D分别是中学化学中常见的四种不同粒子,它们之间有如图的反应关系:
已知:A、B、C、D分别是中学化学中常见的四种不同粒子,它们之间有如图的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+的电子排布式:1s22s22p63s2 |
B、NH4Cl的电子式: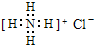 |
| C、氨气的空间结构:三角锥形 |
| D、甲醛结构简式:CH2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com