
分析 (1)根据配制一定物质的量浓度的溶液步骤选用仪器;
(2)高锰酸钾加压强氧化性,在反应中Mn元素的化合价从+7价降低到+2价,得到5个电子.双氧水中氧元素的化合价从-1价升高到0价,失去1个电子;根据电子的得失守恒可知氧化剂高锰酸钾与还原剂双氧水的物质的量之比是2:5,反应在酸性条件下进行,因此反应物还有氢离子参加,据此配平该反应;
(3)根据酸性高锰酸钾溶液具有强氧化性和酸性选用滴定管类型;由于酸性高锰酸钾溶液显紫红色,所以滴定终点现象为当滴入最后一滴KMnO4溶液时,待测液颜色由无色变为浅紫色,且半分钟不褪色;
(4)根据物质的组成可知,加入AgNO3溶液使Cl-完全沉淀的同时,会生成Ag2SO4微溶物,从而使最终测定结果中z值偏高,所以不能用硝酸银溶液代替;
(5)滴定前,滴定管用蒸馏水洗净后,未用KMnO4标准溶液润洗,则导致酸性高锰酸钾溶液的浓度减小,因此再滴定双氧水时,消耗高锰酸钾溶液的体积增加,从而导致y值偏高;
(6)根据题意,确定出Na2SO4、H2O2、NaCl的物质的量之比即可确定硫酸钠-过氧化氢-氯化钠加合物(xNaSO4.y H2O2.zNaCl)的组成.
解答 解:(1)欲配制250.00ml无色溶液A,所需要的仪器除药匙、分析天平、玻璃棒、胶头滴管外,还应有溶解时需要的烧杯以及250ml容量瓶,
故答案为:烧杯、250 mL容量瓶;
(2)高锰酸钾加压强氧化性,在反应中Mn元素的化合价从+7价降低到+2价,得到5个电子.双氧水中氧元素的化合价从-1价升高到0价,失去1个电子.根据电子的得失守恒可知氧化剂高锰酸钾与还原剂双氧水的物质的量之比是2:5.反应在酸性条件下进行,因此反应物还有氢离子参加.又因为原子是守恒的,所以还应该有水生成,因此配平后的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,
故答案为:2;5;6H+;2;5;8H2O;
(3)酸性高锰酸钾溶液具有强氧化性和酸性,因此滴定前,KMnO4标准溶液应盛装于中酸式滴定管中;
由于酸性高锰酸钾溶液显紫红色,所以滴定终点现象为:当滴入最后一滴KMnO4溶液时,待测液颜色由无色变为浅紫色,且半分钟不褪色,
故答案为:酸式滴定管;当滴入最后一滴KMnO4溶液时,待测液颜色由无色变为浅紫色,且半分钟不褪色;
(4)根据物质的组成可知,加入AgNO3溶液使Cl-完全沉淀的同时,会生成Ag2SO4微溶物,从而使最终测定结果中z值偏高,所以不能用硝酸银溶液代替,
故答案为:不能;加入AgNO3溶液使Cl-完全沉淀的同时,要生成Ag2SO4微溶物,会使最终测定结果中z值偏高;
(5)滴定前,滴定管用蒸馏水洗净后,未用KMnO4标准溶液润洗,则导致酸性高锰酸钾溶液的浓度减小,因此再滴定双氧水时,消耗高锰酸钾溶液的体积增加,从而导致y值偏高;
故答案为:偏高;
(6)25.00ml溶液A消耗高锰酸钾溶液的体积是20.00ml,则250ml溶液A消耗高锰酸钾溶液的体积是200.00ml,则高锰酸钾的物质的量=0.2L×0.0400mol/L=0.00800ml.所以根据反应的方程式可知,消耗双氧水的物质的量=(0.00800mol÷2)×5=0.0200mol.25.00ml溶液A得到白色沉淀0.932g,该固体是硫酸钡,物质的量=0.932g÷233g/mol=0.004mol.所以250.00ml溶液A生成白色沉淀的物质的量是0.04mol,即硫酸钠的物质的量是0.04mol.因此6.945g样品中氯化钠的物质的量=$\frac{6.945g-0.04mol×142g/mol-0.02mol×34g/mol}{58.5g/mol}$=0.01mol,则x:y:z=0.04:0.02:0.01=4:2:1,
所以其化学式为4Na2SO4?2H2O2?NaCl,
故答案为:4Na2SO4?2H2O2?NaCl.
点评 本题考查较为综合,涉及配制一定浓度的溶液方法、氧化还原反应的配平、复杂化学式的确定、中和滴定、实验方案的评价等知识,题目难度中等,明确实验目的、实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应后生成NO的体积为28 L | B. | 所得溶液中c(Fe2+):c(Fe3+)=1:1 | ||
| C. | 所得溶液中c(NO3-)=2.75 mol/L | D. | 所得溶液中的溶质只有FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
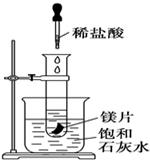 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H<0,△S>0 | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ/mol | |
| C. | 铜分别与浓HNO3、稀HNO3反应,还原产物分别为NO2、NO,所以浓HNO3氧化性小于稀HNO3 | |
| D. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
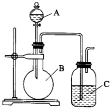 某同学设计如图装置,探究非金属性质变化规律.
某同学设计如图装置,探究非金属性质变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
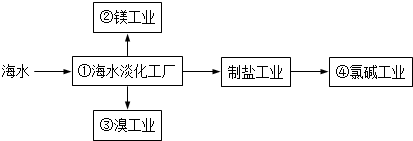
| A. | ①中可采用蒸馏法 | B. | ②中可通过电解法制金属镁 | ||
| C. | ③中提溴涉及到复分解反应 | D. | ④的产品可生产盐酸、漂白液等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 g H218O与10 g D2O所含的中子数均为5NA | |
| B. | 2.4 g Mg在空气中充分燃烧,转移电子数为0.2NA | |
| C. | l L0.1 mol•L-l NH4Cl溶液中所含NH4+数为0.1NA | |
| D. | 100 g质量分数为46%的酒精水溶液中含氧原子总数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com