
| K1 | K2 | |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
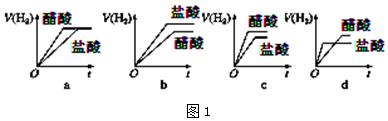
分析 (1)pH相同、体积相同的醋酸和盐酸两种溶液总氢离子浓度相同,则醋酸溶液中溶质浓度大于盐酸溶液中HCl的浓度,盐酸是强酸,醋酸是弱酸,所以醋酸溶液中存在电离平衡,升高温度能促进弱电解质电离,pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,不同的酸和相同金属反应,生成氢气的速率与溶液中离子浓度成正比.
①醋酸存在电离平衡,稀释后又电离出氢离子;
②醋酸溶液浓度大于盐酸;
③盐酸是强酸,不存在电离平衡,升高温度不影响盐酸的pH,醋酸是弱酸,其水溶液中存在电离平衡,升高温度,促进醋酸电离;
④相同体积、相同pH的醋酸和盐酸溶液,初始时C(H+)相同,开始反应速率相同,反应一旦开始,醋酸溶液还会电离出新的C(H+),即随后醋酸溶液电离出的C(H+)大于盐酸;同体积,相同PH的盐酸溶液①和醋酸溶液②相比,醋酸溶液②的浓度大,与足量的锌粉反应产生的氢气体积大,反应过程中醋酸溶液②继续电离,溶液中氢离子浓度大,产生氢气速率快;
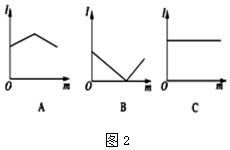
(2)溶液导电能力与离子浓度成正比,与电荷成正比,与电解质强弱无关,
A中溶液导电能力先增大后减小,则A溶液中离子浓度先增大后减小;
B中溶液导电能力先减小后增大,则B溶液中离子浓度先减小后增大;
C中溶液导电能力不变,说明C溶液中离子浓度不变,据此分析解答;
(3)①HSO3-的电离平衡常数表达式用离子浓度幂乘积除以亚硫酸根来做的浓度;
②由表可知H2SO3的二级电离小于H2CO3的一级电离,则酸性强弱H2SO3>H2CO3>HSO3-,所以反应生成HSO3-和CO2.
解答 (1)pH相同、体积相同的醋酸和盐酸两种溶液总氢离子浓度相同,则醋酸溶液中溶质浓度大于盐酸溶液中HCl的浓度,
①pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,溶液中氢离子浓度都减小,所以pH都增大,醋酸是弱酸存在电离平衡,又电离出氢离子,醋酸溶液中的c(H+)>盐酸溶液中的c(H+),故答案为:>;
②pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积醋酸>盐酸,故答案为:>;
③盐酸是强酸,不存在电离平衡,升高温度不影响盐酸的pH,醋酸是弱酸,其水溶液中存在电离平衡,升高温度,促进醋酸电离,导致醋酸溶液中氢离子浓度增大,所以醋酸的pH减小,溶液中c(H+):醋酸>盐酸,故答案为:>;
④因为强酸完全电离,一元弱酸部分电离,因此要有相同的PH值,一元弱酸的浓度必须比强酸高,由于体积相等,因此一元弱酸的物质的量大于强酸,因此产生的H2也比强酸多.反应过程由于H+不断被消耗掉,促使一元弱酸继续电离,这就延缓了H+浓度下降的速率,而强酸没有H+的补充途径,浓度下降的更快,由于其他条件都相同,反应速率取决于H+浓度,由于开始时H+浓度相等,因此反应速率也相等(在图中反应速率就是斜率),后面强酸的反应速率下降得快,斜率也就更小,曲线更平坦.最终生成H2的体积也比一元弱酸少,因此曲线在一元弱酸下面;
故选c,
故答案为:c;
(2)溶液导电能力与离子浓度成正比,与电荷成正比,与电解质强弱无关,
A中溶液导电能力先增大后减小,则A溶液中离子浓度先增大后减小;
B中溶液导电能力先减小后增大,则B溶液中离子浓度先减小后增大;
C中溶液导电能力不变,说明C溶液中离子浓度不变,
①.该反应方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,随着稀硫酸的加入,离子浓度减小,当二者恰好反应时离子浓度最小,溶液导电能力最小;继续加入稀硫酸时,离子浓度增大,溶液导电能力增大,故答案为:B;
②.离子反应方程式为CH3COOH+NH3.H2O=NH4++CH3COO-,随着一水合氨的加入,离子浓度增大,溶液导电能力增大,二者恰好反应时溶液导电能力最大;继续加入氨水,离子浓度减小,溶液导电能力减小,故答案为:A;
③.离子反应方程式为Ca2++2OH-+CO2=CaCO3↓+H2O,随着二氧化碳的通入,离子浓度减小,溶液导电能力降低,二者恰好反应时离子浓度最小,溶液导电能力最低,继续通入二氧化碳,二者反应生成可溶性强电解质,CaCO3+H2O+CO2=Ca(HCO3)2,离子浓度增大,溶液导电能力增强,故答案为:B;
(3)HSO3-的电离平衡常数表达式为:K=$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$,故答案为:$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$;
②由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,
故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O.
点评 本题考查溶液导电能力图象分析、酸的电离常数判断酸的酸性强弱,为高频考点,明确溶液导电性强弱与离子浓度关系是解本题关键,注意溶液导电性强弱与电解质强弱无关,题目难度中等.


科目:高中化学 来源: 题型:解答题
 反应:aA(g)+bB(g)?cC(g)△H<0 在2L恒容容器中进行.改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
反应:aA(g)+bB(g)?cC(g)△H<0 在2L恒容容器中进行.改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
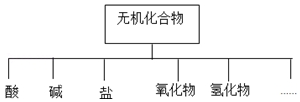
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② | ③NaOH ④ | ⑤Na2SO4 ⑥ | ⑦SO2 ⑧ | ⑨NH3 ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2 | B. | NaOH | C. | BaCl2 | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3 | B. | NaOH | C. | H2SO4 | D. | CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com