
顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:
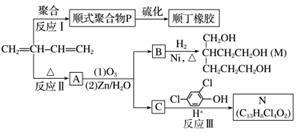
已知:ⅰ.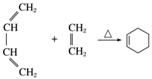
ⅱ.RCH===CHR′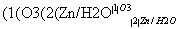 RCHO+R′CHO(R、R′代表烃基或氢)
RCHO+R′CHO(R、R′代表烃基或氢)
(1)CH2===CH—CH===CH2的名称是______________。
(2)反应Ⅰ的反应类型是(选填字母)________。
a.加聚反应 b.缩聚反应
(3)顺式聚合物P的结构式是(选填字母)________。

(4)A的相对分子质量为108。
①反应Ⅱ的化学方程式是__________________________________________________。
②1 mol B完全转化成M所消耗H2的质量是______g。
(5)反应Ⅲ的化学方程式是______________________________________________。
(6)A的某些同分异构体在相同的反应条件下也能生成B和C。写出其中一种同分异构体的结构简式________________。
答案 (1)1,3丁二烯 (2)a (3)b
(4)①2CH2===CH—CH===CH2
②6
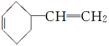
(5)
(6)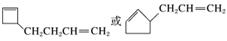
解析 (1)CH2===CH—CH===CH2分子中含有2个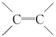 ,属于二烯烃,根据系统命名法原则,其名称为1,3丁二烯。
,属于二烯烃,根据系统命名法原则,其名称为1,3丁二烯。
(2)CH2===CH—CH===CH2分子中含有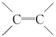 ,具有烯烃的化学性质,能发生加成反应和加聚反应等,该有机物经反应Ⅰ生成顺式聚合物P,则反应Ⅰ为加聚反应。
,具有烯烃的化学性质,能发生加成反应和加聚反应等,该有机物经反应Ⅰ生成顺式聚合物P,则反应Ⅰ为加聚反应。
(3)迁移应用课本中顺反异构体知识,推测顺式聚合物P分子中连接在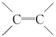 两端碳原子的同种基团处于双键的同侧,故b项正确。
两端碳原子的同种基团处于双键的同侧,故b项正确。
(4)①结合题给信息ⅰ中加成反应(成环反应)原理,推测反应Ⅱ为2分子CH2===CH—CH===CH2在加热条件下发生加成反应(成环反应)生成A。又知A的相对分子质量为108,从而确定A的结构简式为 ,反应的化学方程式为2CH2===CH—CH===CH2
,反应的化学方程式为2CH2===CH—CH===CH2 。
。
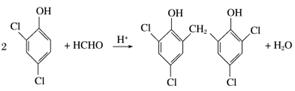
②结合信息ⅱ中反应原理, 在O3、Zn/H2O作用下,发生开环反应,生成
在O3、Zn/H2O作用下,发生开环反应,生成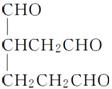 和HCHO,结合M的结构简式可知,B为
和HCHO,结合M的结构简式可知,B为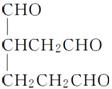 ,
,
C为HCHO。1 mol B含有3 mol—CHO,可与3 mol H2完全加成,消耗H2的质量为6 g。
(5)N的分子式为C13H8Cl4O2,而C的分子式为CH2O,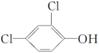 的分子式为C6H4Cl2O,由酚羟基邻位上的氢原子较活泼,可推出N的结构简式为
的分子式为C6H4Cl2O,由酚羟基邻位上的氢原子较活泼,可推出N的结构简式为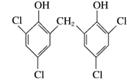 。所以反应Ⅲ的化学方程式为
。所以反应Ⅲ的化学方程式为
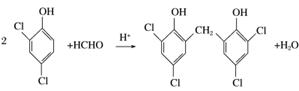 。
。
(6)A的结构简式为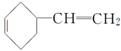 ,其同分异构体在O3、Zn/H2O作用下,也能生成B(
,其同分异构体在O3、Zn/H2O作用下,也能生成B(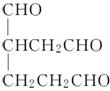 )和C(HCHO),根据该反应的原理,逆向推理知A的同分异构体的结构简式可能为
)和C(HCHO),根据该反应的原理,逆向推理知A的同分异构体的结构简式可能为
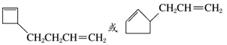 。
。


科目:高中化学 来源: 题型:
化学上常用燃烧法确定有机物的组成。这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示装置是用燃烧法确定有机物分子式常用的装置。

回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是_________________。
(2)C装置中浓H2SO4的作用是_______________________________________。
(3)D装置中MnO2的作用是________________________________________。
(4)燃烧管中CuO的作用是________________________________________。
(5)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物的最简式为___________________________。
(6)要确定该有机物的分子式,还要___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下。

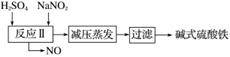
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题。
(1)加入少量NaHCO3的目的是调节pH,使溶液中的______沉淀,该工艺中“搅拌”的作用是__________。
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH)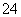 。该水解反应的离子方程式为__________________。
。该水解反应的离子方程式为__________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO 。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A.氯水 B.KSCN溶液
C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
柑橘中柠檬烯的结构可表示为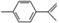 ,下列关于这种物质的说法中正确的是( )
,下列关于这种物质的说法中正确的是( )
A.与苯的结构相似,性质也相似
B.可使溴的四氯化碳溶液褪色
C.易发生取代反应,难发生加成反应
D.该物质极易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法中错误的是( )
A.石油裂解能得到乙烯,乙烯是生产聚乙烯的原料
B.甲烷、苯都属于烃,都不存在同分异构体
C.葡萄糖可转化为乙醇,乙醇氧化可得到乙醛
D.煤干馏是复杂的物理化学变化,石油分馏是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对有机物结构或性质的描述中错误的是( )
A.将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应
B.苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键
C.乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O
D.一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬烯是一种食用香料,其结构简式如图所示。
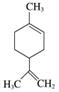
下列有关柠檬烯的分析正确的是( )
A.它的一氯代物有8种
B.它的分子中所有的碳原子一定在同一平面上
C.它和丁基苯(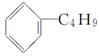 )互为同分异构体
)互为同分异构体
D.一定条件下,它分别可以发生加成、取代、氧化、还原等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
CuSO4溶液与K2C2O4溶液混合生成一种蓝色钾盐水合物KxCuy(C2O4)z·nH2O。通过下述实验确定该晶体的组成。(已知:MnO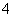 在酸性条件下,加热能分解为O2,同时生成Mn2+。)
在酸性条件下,加热能分解为O2,同时生成Mn2+。)
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL KMnO4溶液。有关反应:2MnO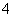 +5C2O
+5C2O +16H+===2Mn2++8H2O+10CO2↑。
+16H+===2Mn2++8H2O+10CO2↑。
步骤b:接着将溶液充分加热。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL Na2S2O3溶液。滴定时反应为I2+2S2O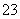 ===2I-+S4O
===2I-+S4O 。
。
(1)步骤b中生成白色沉淀的离子方程式:________________________________________________________________________。
(2)步骤b中“将溶液充分加热”的目的是________________________________________________________________________。
(3)请完成下列确定样品组成的计算过程。
①计算样品中n(C2O )(写出计算过程)
)(写出计算过程)
________________________________________________________________________。
②计算样品中n(Cu2+)(写出计算过程)
________________________________________________________________________。
③根据________原理可求出n(K+),再依据________原理求得n(H2O)。
④该样品晶体的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
 CaCl2固体 30%的H2O2
CaCl2固体 30%的H2O2











NH3 副产品 产品
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________________________________________________________________________
________________________________________________________________________。
(2)检验“水洗”是否合格的方法是________。
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①________________________________________________________________________;
②________________________________________________________________________。
(4)测定产品中CaO2含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
(已知:I2+2S2O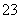 ===2I-+S4O
===2I-+S4O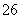 )
)
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com