
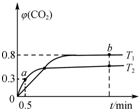
 利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | T1<T2,△H>0 | |
| B. | T1温度下,该反应的平衡常数为1 024 | |
| C. | T2温度下,0~0.5 min内,CO的平均反应速率为0.3 mol•L-1•min-1 | |
| D. | T1温度下,若向装有足量I2固体的2 L恒容密闭容器中通入10 mol CO2,达到平衡时,φ(CO2)=0.8 |
分析 A、图象分析可知,先拐先平,温度高,得到T1<T2 ,依据化学平衡移动原理,温度越高二氧化碳体积分数越小,说明平衡逆向进行;
B、T1温度下达到平衡,二氧化碳体积分数为0.8,结合化学平衡三段式列式计算平衡浓度,平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
C、图象可知T2温度下,0~0.5 min内二氧化碳体积分数为0.3,结合化学平衡三段式列式计算,反应速率v=$\frac{△c}{△t}$计算;
D、反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s),反应前后气体体积不变,充入10 mol CO2,增大压强,化学平衡不变,所以二氧化碳体积分数不变.
解答 解:A、图象分析可知,先拐先平,温度高,得到T1<T2 ,依据化学平衡移动原理,温度越高二氧化碳体积分数越小,说明平衡逆向进行,升温平衡向吸热反应方向进行,所以逆反应为吸热反应,正反应为放热反应△H<0,故A错误;
B、T1温度下达到平衡,二氧化碳体积分数为0.8,一氧化碳转化x
5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量(mol/L) 1 0
变化量(mol/L) x x
平衡量(mol/L) 1-x x
$\frac{x}{1-x+x}$=0.8
x=0.8mol/L
平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{{x}^{5}}{(1-x)^{5}}$=$\frac{0.{8}^{5}}{(1-0.8)^{5}}$=1024,故B正确;
C、图象可知T2温度下,0~0.5 min内二氧化碳体积分数为0.3,
5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量(mol/L) 1 0
变化量(mol/L) x x
5min量(mol/L) 1-x x
$\frac{x}{1-x+x}$=0.3
x=0.3
由反应速率v=$\frac{△c}{△t}$可知CO的平均反应速率=$\frac{0.3mol/L}{0.5min}$=0.6mol•L-1•min-1,故C错误;
D、反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s),反应前后气体体积不变,充入10 mol CO2,增大压强,但平衡不变,所以平衡后二氧化碳体积分数不变为0.8,故D正确;
故选BD.
点评 本题考查了化学反应速率、平衡常数概念的计算分析,注意图象分析判断方法,化学平衡移动原理的理解应用和影响平衡因素的理解应用,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/mL | 测得生成沉淀的质量/g |
| 1 | 0.858 | 500 | 1.379 |
| 2 | 1.716 | 500 | |
| 3 | 2.574 | 500 | 4.137 |
| 4 | 3.432 | 500 | 5.516 |
| 5 | 4.290 | 500 | 5.516 |
| 6 | 5.148 | 500 | 5.516 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 限定条件 | 数目 |
| A | C2H4O2 | 能与Na2CO3溶液反应 | 2 |
| B | C4H8Cl2 | 分子中有一个甲基 | 3 |
| C | C4H10O | 不能与钠反应 | 2 |
| D | C8H10 | 含有苯环 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | V(0.5mol•L-1 HCl)/mL | m(CaCO3)/g | CaCO3状态 | V(蒸馏水)/mL | 实验目的 | |
| 实验1 | 40.0 | 0.8 | ①实验1和2探究固体表面积对反应速率的影响; ②实验1和3探究反应物浓度对反应速率的影响 | |||
| 实验2 | 40.0 | 0.8 | ||||
| 实验3 | 60.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都可以 | B. | 只有①不能发生 | C. | 只有②不能发生 | D. | 只有①④不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
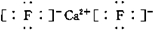 ;若XY2为共价化合物时,其结构式为:S=C=S.
;若XY2为共价化合物时,其结构式为:S=C=S.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l);△H=-Q1 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-Q2 kJ•mol-1 | |
| C. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1 | |
| D. | $\frac{1}{3}$H3PO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{6}$Ba3(PO4)2(s)+H2O(l);△H=-Q4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入3mol/L的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率 | |
| D. | 500mL 1mol/L的稀HCl与锌粒反应,将500mL 1mol/L的HCl改为1000mL 1mol/L的盐酸会使反应速率减慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com