
【题目】一定温度下,固定容积的密闭容器中发生下列反应:![]() 反应过程中,各物质浓度与时间的关系如图:
反应过程中,各物质浓度与时间的关系如图:
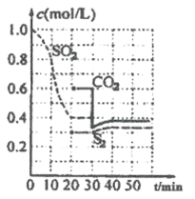
(1)该反应平衡常数表达式为![]() ____________。
____________。
(2)![]() 化学反应速率表示
化学反应速率表示![]() ______;建立平衡过程中,混合气体的密度______(选填“增大”、“减小”或“不变”)。
______;建立平衡过程中,混合气体的密度______(选填“增大”、“减小”或“不变”)。
(3)![]() 时改变外界条件,使
时改变外界条件,使![]() ______
______![]() (选填“大于”、“小于”或“等于”)。
(选填“大于”、“小于”或“等于”)。
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是

A. 反应①为取代反应,有机产物与水混合浮在上层
B. 反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C. 反应③为取代反应,有机产物是一种烃
D. 反应④中1 mol苯最多与3 mol H2发生加成反应,因为每个苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中前三周期部分元素的原子序数与常见价态的关系图如下。若用原子序数表示对应元素,下列说法中不正确的是

A.a与d的非金属性比较:a> d
B.原子半径大小:b>c>a>d>e
C.a可以形成两种氢化物
D.b、c、e的最高价氧化物对应水化物之间均可反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的H2SO4溶液中,分别滴人物质的量浓度相等的Ba(OH)2、NaOH溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析正确的是( )
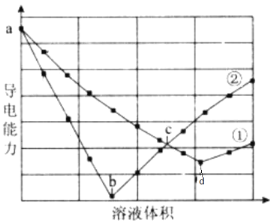
A.①代表滴加Ba(OH)2溶液的变化曲线B.ab段发生反应的离子方程式为:OH-+H+=H2O
C.b、d两点对应的溶液均显中性D.c点对应的两溶液中含有相等量的OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中泄露的二氧化硫,会被氧化而形成硫酸雾或硫酸盐气溶胶,污染环境。工业上常用![]() 溶液吸收、活性炭还原等方法处理二氧化硫,以减小对空气的污染。
溶液吸收、活性炭还原等方法处理二氧化硫,以减小对空气的污染。
(1)写出用![]() 溶液吸收
溶液吸收![]() 的离子方程式____________。
的离子方程式____________。
(2)钠原子核外有______种能量不同的电子。写出硫原子最外层电子的轨道表示式____________。
(3)![]() 比
比![]() 稳定,请用分子结构的知识简述其理由。__________________
稳定,请用分子结构的知识简述其理由。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。忽略溶液体积变化,下列叙述不正确的是
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A.该反应可用MnO2、FeCl3溶液作为催化剂
B.0~4 min的平均反应速率v(H2O2)=3.75×10-2mol/(L·min)
C.0~10 min,过氧化氢的分解速率逐渐加快
D.反应到6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性条件下,![]() 与
与![]() 按物质的量
按物质的量![]() 恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。
恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。
(________)H++(________)NO2-+(________)I-→(_________)+(__________)+(__________)H2O
根据上述离子方程式,1摩尔![]() 参与反应则转移的电子数目是______,反应中被还原的元素是______。
参与反应则转移的电子数目是______,反应中被还原的元素是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素。
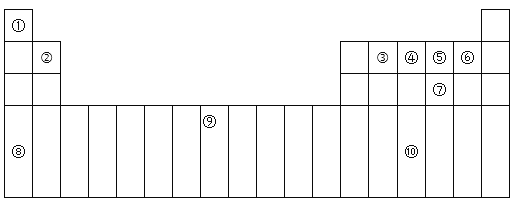
(1)在①~⑩元素的电负性最大的是:_____(填化学式)。
(2)⑨元素有____种运动状态不同的电子。
(3)⑩的基态原子的价电子排布式为:_________。
(4)⑤的氢化物与⑦的氢化物比较稳定的是:___,沸点较高的是:____(填化学式)。
(5)元素⑦和⑧形成的化合物属于____晶体,它比Na2O的熔点____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法正确的是( )
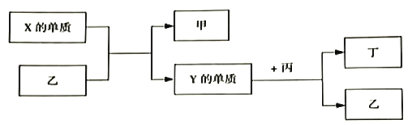
A. 原子半径由小到大的顺序是:W<Z<Y<X
B. Z的最高价氧化物对应的水化物一定为强酸
C. 化合物的沸点由高到低的顺序是:乙>甲>丙
D. Y与W、Z都只能形成两种化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com