
分析 根据n=$\frac{m}{M}$计算13.0g锌的物质的量,根据方程式Zn+2HCl=ZnCl2+H2↑,计算n(ZnCl2)、n(HCl)、n(H2),根据V=nVm计算氢气的体积,再根据c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:13.0g锌的物质的量n=$\frac{13g}{65g/mol}$=0.2mol,由于和盐酸恰好完全反应,设生成的氯化锌的物质的量为xmol,反应掉的盐酸的物质的量为ymol,生成的氢气的物质的量为zmol,则有:
Zn+2HCl=ZnCl2+H2↑
1 2 1 1
0.2mol ymol xmol zmol
则有:$\frac{1}{0.2mol}=\frac{2}{ymol}=\frac{1}{xmol}=\frac{1}{zmol}$
解得x=0.2mol,y=0.4mol,z=0.2mol
(1)生成氯化锌的物质的量为0.2mol.答:生成氯化锌的物质的量为0.2mol;
(2)溶液中盐酸的物质的量为0.4mol,故物质的量浓度c=$\frac{0.4mol}{0.2L}$=2mol/L,答:盐酸的物质的量浓度为2mol/L;
(3)生成氢气的物质的量为0.2mol,在标况下的体积V=nVm=0.2mol×22.4L/mol=4.48L.答:生成氢气在标况下为4.48L.
点评 本题考查根据方程式的计算、常用化学计量的有关计算,比较基础,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 23g金属钠变为钠离子时失电子数目为1 NA | |
| B. | 18g水所含有的电子数为NA | |
| C. | 4克氢气所含的分子数为NA | |
| D. | 4gCH4所含有的氢原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 石油的主要成分是烃,煤经过分馏可制得焦炭、煤焦油等产品 | |
| C. | 丙烯分子中所有原子不可能在同一平面上 | |
| D. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
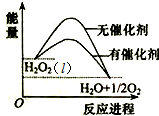
| A. | 加入催化剂,减小了反应的热效应(l) | |
| B. | 加入催化剂,不能提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2(l)═H2O(l)+$\frac{1}{2}$O2 (g)△H>0 | |
| D. | 无法比较反应物的总能量和生成物的总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
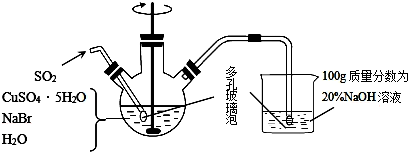
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 组成元素相同,组成元素的质量分数也对应相等的不同化合物,一定互为同分异构体 | |
| B. | 组成元素相同,相对分子质量相同的几种化合物,互为同分异构体 | |
| C. | 摩尔质量相同,各元素质量分数也对应相等的不同化合物,一定是同分异构体 | |
| D. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com