
| A. | 由6molCuFeS2生成6molCu,共消耗16.5molO2 | |
| B. | 该冶炼方法中产生大量的有害气体SO2,可回收用于制取硫酸 | |
| C. | 在反应③中,Cu2S既是氧化剂,又是还原剂 | |
| D. | 在反应①中,SO2既是氧化产物,又是还原产物 |
分析 A、根据最终产物为Cu、SO2和FeO可写出反应的总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,根据方程式计算;
B、二氧化硫能用来制取硫酸;
C、2Cu2O+Cu2S═Cu+SO2↑中,Cu元素的化合价由+1价降低为0,S元素的化合价由-2价升高为+4价,以此来解答;
D、2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣)中,Cu元素的化合价由+2价降低为+1价,O元素的化合价由0降低为-2价,而S元素的化合价由-2价升高为0;
解答 解:A、2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣);制粗铜时,在1200℃发生的主要反应为:②2Cu2S+3O2$\frac{\underline{\;1200℃\;}}{\;}$2Cu2O+2SO2,③2Cu2O+Cu2S$\frac{\underline{\;1200℃\;}}{\;}$6Cu+SO2↑,所以总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,根据方程式知由6mol CuFeS2制取6 mol Cu时共消耗15mol O2,故A错误;
B、在铜的冶炼过程中,②焙烧、③制粗铜过程中都有二氧化硫生成,二氧化硫被氧化生成三氧化硫,三氧化硫和水反应生成硫酸,所以所以冶炼过程中的尾气可用来制硫酸,故B正确;
C.在反应③中,Cu元素的化合价降低、S元素的化合价升高,则Cu2S既是氧化剂,又是还原剂,故C正确;
D.在反应①中,O元素的化合价降低,S元素的化合价升高,则SO2既是氧化产物,又是还原产物,故D正确;
故选A.
点评 本题考查金属的冶炼考查氧化还原,为高频考点,题目难度不大,把握反应中各元素的化合价的变化为解答的关键,选项A为解答的难点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 15种 | B. | 14种 | C. | 13种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
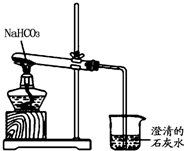 Na2CO3和NaHCO3是两种常见的钠盐.
Na2CO3和NaHCO3是两种常见的钠盐.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的两种盐与足量盐酸反应,在相同条件下Na2CO3产生的CO2的体积小 | |
| B. | 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3两倍 | |
| C. | 将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生白色沉淀 | |
| D. | 等物质的量浓度的两种溶液,Na2CO3溶液的pH大于NaHCO3溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸见光易分解,故需保存在棕色瓶中 | |
| B. | Na2CO3、NaAlO2溶液显碱性,故只能用橡胶塞保存 | |
| C. | FeCl2溶液保存时需加入少量铁粉和盐酸 | |
| D. | 少量白磷可保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

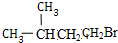 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +NaBr+H2O;
+NaBr+H2O; +HBr$\stackrel{△}{→}$
+HBr$\stackrel{△}{→}$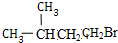 +H2O;
+H2O; ;
;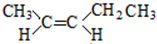 和
和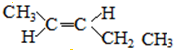 ;
;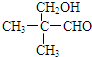 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
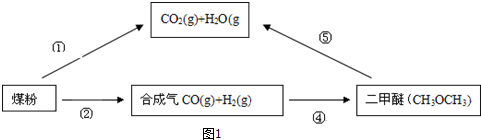
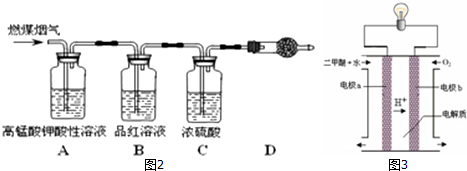
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com