
【题目】有下列4种有机化合物
A:CH2=CH2 B:![]() C:CH3COOH D:
C:CH3COOH D: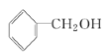
(1)写出化合物A、C中官能团的名称________、_______;
(2)4种化合物中能使溴的四氯化碳溶液褪色的是____(写名称);反应的化学方程为:_____;具有特殊气味、常做有机溶剂的是_____(写名称)。
(3)4种化合物中能与NaOH发生中和反应的是_____(写名称)。
(4)C与D在浓硫酸存在下,加热时生成的有机物的结构简式:_______。
【答案】碳碳双键 羧基 乙烯 CH2=CH2+Br2→CH2Br-CH2Br 苯 乙酸 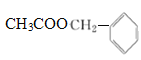
【解析】
(1)根据A、C的结构简式分析官能团;
(2)烯烃能与溴的四氯化碳溶液发生加成反应;苯是常见的有机溶剂;
(3)羧酸能与NaOH发生中和反应;
(4)羧酸与醇在浓硫酸存在下发生酯化反应生成酯和水;
(1)A是乙烯,官能团是碳碳双键,C是乙酸,官能团是羧基;
(2)乙烯含有碳碳双键可与溴水发生加成反应是溴水褪色,反应的化学方程式为:CH2=CH2+Br2→CH2Br-CH2Br;苯是有特殊香味的液体,是常见的有机溶剂;
(3)能与NaOH发生中和反应则该物质具有酸性,三种物质中有酸性的是乙酸;
(4)CH3COOH与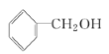 在浓硫酸存在下发生酯化反应,生成的酯的结构简式是
在浓硫酸存在下发生酯化反应,生成的酯的结构简式是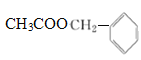 。
。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A. 相同质量的CO与N2,所含分子数、原子数均相同
B. 31g白磷中所含共价键数目为NA
C. 56g乙烯中所含共用电子对数目为12NA
D. 14g乙烯与丙烯的混合气体中所含氢原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W是前四周期元素,原子序数依次增大,X元素原子最外层电子数是内层的2倍,Y的原子半径是在同周期中最大;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子己全充满,最外层只有2个电子。
请回答下列问题:
(1)Y元素在周期表中的位置是_________; W2+离子的价电子排布式为__________。
(2)X能与S、氮、氧二种元素构成化合物XO(NH2)2,其中X原子和N原子的杂化方式为分别为_____、____,该化合物分子中的π键与![]() 键的个数之比是____;该物质易溶于水的主要原因是____。
键的个数之比是____;该物质易溶于水的主要原因是____。
(3)己知Be和A1元素处于周期表中对角线位置,化学性质相似,请写出Y元素的最高价氧化物对应水化物与Be相互反应的化学方程式:____________。
(4)M晶体的原子堆积如图所示,则该晶体的堆积方式为________,晶体中M原子的配位数是_____。某M配合物的化学式是[M(H2O)5C1]Cl2·H2O,1mol该配合物中含配位键是_____mol。

(5)Y离子和Z离子比较,半径较大的是__________(填离子符号)元素Y与元素Z形成了晶体的晶胞结构是如图所示的正方体,每个Y离子周围与它最接近的Y离子有__________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2,5-二羟基苯甲酸甲酯俗称龙胆酸甲酯,可由龙胆酸与甲醇酯化得到,是合成制药中的常见中间体。其结构如图所示。
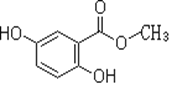
回答以下问题:
(1)龙胆酸甲酯的分子式为__________
(2)下列有关龙胆酸甲酯的描述,正确的是_____(填字母)。
a.能发生消去反应 b.能与氢气发生加成反应 c.能与浓溴水反应
(3)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式_________ 。
(4)写出满足下列条件的龙胆酸的两种同分异构体的结构简式_______、_______。
①能发生银镜反应; ②能使FeCl3溶液显色;
③酯类 ④苯环上的一氯代物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是
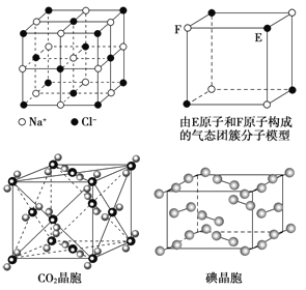
A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 每个该气态团簇分子的分子中含有1/2个E原子
C. 在CO2 晶体中,一个CO2 分子周围有12个CO2 分子紧邻
D. 在碘晶体中,碘分子的排列有两种不同的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol L-1HB溶液中逐滴滴入 0.1mol L-1NaOH溶液,所得 PH变化曲线如图所示。下列说法错误的是

A.OA各点溶液均存在:c(B-) >c(Na+)
B.C至 D各点溶液导电能力依次增强
C.点 O时,pH>1
D.点 C时,X约为 10.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A.铜电极上发生氧化反应
B.电池工作一段时间后,乙池溶液的总质量增加
C.电池工作一段时间后,甲池的c(![]() )减小
)减小
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有含有SO2和NOx的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表》
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“提高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
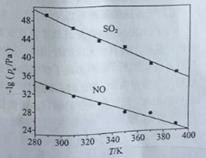
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的有点是_______。
②已知下列反应:
SO2(g)+2OH(aq) ===SO32(aq)+H2O(l) ΔH1
ClO(aq)+SO32(aq) ===SO42(aq)+Cl(aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO(aq) +2OH(aq) ="==" CaSO4(s) +H2O(l) +Cl(aq)的ΔH=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com