
| B的取值范围 | ||||
| NaOH溶液的浓度(mol/L) |
| 2mol |
| 1L |
| 2mol |
| 1L |
| 1mol |
| 1L |
| B的取值范围 | B>106 | B=106 | B=84 | 84<B<106 |
| NaOH溶液的浓度(mol/L) | c(NaOH)>2mol/L; | c(NaOH)=2mol/L; | c(NaOH)=1mol/L | 1mol/L<c(NaOH)<2mol/L |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、使用催化剂是为了加快反应速率,提高生产效率 |
| B、在上述条件下,SO2不可能100%地转化为SO3 |
| C、为了提高SO2的转化率,应适当提高O2的浓度 |
| D、达到平衡时,SO2的浓度与SO3的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第Ⅰ栏 | 第Ⅱ栏 | 第Ⅲ栏 | |
| A | 往AlCl3溶液里滴入少量氨水 | 往AlCl3溶液里滴入过量氨水 | 3NH3?H2O+H2O+Al3+=3NH4++Al(OH)3↓ |
| B | 往Fe(SO4)3溶液里滴入氢氧化钠溶液 | 往Fe(SO4)3溶液里滴入氢氧化钡溶液 | 3OH-+Fe3+=Fe(OH)3↓ |
| C | 向NH4HSO4溶液中滴入氢氧化钠溶液 | 向氢氧化钠溶液中滴入NH4Cl溶液 | NH4++OH-=NH3?H2O |
| D | 往NaOH溶液里通入过量CO2气体 | 往NaOH溶液里通入少量CO2气体 | CO2+OH-=HCO3- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞.已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图 则该物质的化学 ( )
许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞.已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图 则该物质的化学 ( )| A、Ca4TiO3 |
| B、Ca4TiO6 |
| C、CaTiO3 |
| D、Ca8TiO12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
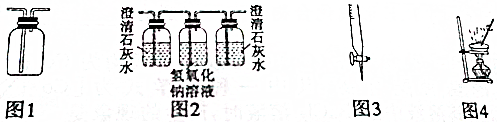
| A、用图1所示装置可以收集H2、NH3、CO2、NO2等气体 |
| B、用图2所示装置可以验证SO2气体中含有CO2气体 |
| C、用图3所示仪器可以量取Na2CO3溶液 |
| D、用图4所示装置可以进行硫酸铜晶体中结晶水含量的测定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com