
【题目】下列有关物质用途的叙述不正确的是
A. 氧化镁(熔点2800℃)是优质的耐高温材料
B. 还原铁粉可用作食品袋内的抗氧化剂
C. 高炉炼铁过程中用石灰石与二氧化硅反应形成炉渣
D. 晶体硅是一种半导体材料,常用于制造光导纤维
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】X是某药物的中间体,其结构简式如图所示。下列有关X的说法正确的是
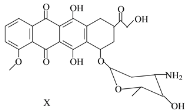
A. 每个X分子中含有5个手性碳原子
B. 一定条件下,X能与乙醇发生酯化反应
C. 一定条件下,X能发生消去反应
D. X既能与盐酸反应,又能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳铵是一种较常使用的化肥,它在常温下易分解.某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究.
(定性实验)检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色.
(1)根据实验现象,推测碳铵中所含有阴离子可能是_________和__________;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是________________;
(定量试验)测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示.
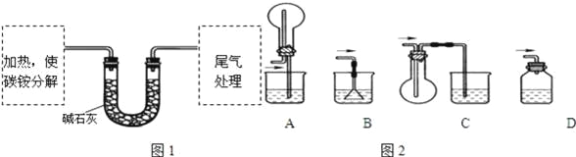
(3)碳铵固体应放在________中进行加热.
A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
(4)从安全的角度考虑,尾气处理的装置可以选用如图2中的___________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将可能混有NaOH的16.80gNaHCO3固体,在200℃条件下充分加热,排出反应产生的气体,得到固体的质量为bg。
(1)b的最小值为___________。
(2)当b=____________时,产物中水的质量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Atropic 酸(H)是某些具有消炎、镇痛作用药物的中间体,其一种合成路线如下:
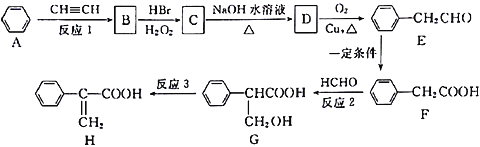
(1)G中含氧官能团的名称是____________;反应1为加成反应,则B的结构简式是________________。
(2)反应2的反应类型为________________,反应3的反应条件为________________。
(3)C→D的化学方程式是________________________________。
(4)写出E与银氨溶液水浴反应的离子方程式_______________________________。
(5)下列说法正确的是________。
a. B中所有原子可能在同一平面上
b. 合成路线中所涉及的有机物均为芳香族化合物
c.一定条件下1mol有机物H最多能与5molH2发生反应
d. G能发生取代、加成、消去、氧化、缩聚等反应
(6)化合物G有多种同分异构体,其中同时满足下列条件:①能发生水解反应和银镜反应; ②能与FeC13发生显色反应;③核磁共振氢谱只有4个吸收峰的同分异构体的结构简式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量 | 密度/(gcm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
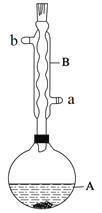
实验步骤:
在A中加入4.4 g异戊醇(3-甲基-1-丁醇)、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的具体名称是____________,实验时冷却水的进水口是_____(a或b)。
(2)在洗涤操作中,先水洗再饱和NaHCO3溶液洗而不是直接用饱和NaHCO3溶液洗涤的原因是____________________。
(3)该制备反应的化学反应方程式为__________________________。
(4)本实验中加入过量乙酸的目的是___________________________。
(5)本实验中不能用生石灰代替无水MgSO4的原因________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是___________(填标号)。
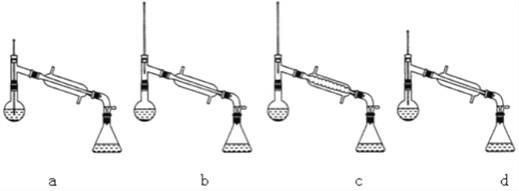
(7)本实验的产率是___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是( )
A. 常温常压下,64g SO2中含有的原子数为3NA
B. 标准状况下,11.2L CCl4所含原子数目为2.5NA
C. 2L 0.1 molL﹣1K2SO4溶液中含K+物质的量为0.2 mol
D. 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,下列说法正确的是( )

A. 甲气体肯定有NO2
B. 经过浓硫酸处理后余气中NO、CO2体积比为2:3
C. 甲气体的组成可能为NH3、NO、NO2
D. 经过Na2O2处理后剩余气体体积大于80mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH-=2NO2-+H2O②气体液化的温度:NO2 21℃、 NO –152℃

(1)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是__________。
(2)该实验装置明显缺陷是 ________________________________________________。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是____________________________。
②装置B的作用是_______________________________________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)①水合肼(N2H4·H2O)是一种重要的化工原料,在医药、农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用NaClO溶液、NaOH溶液与尿素[CO(NH2)2]反应制得粗肼(N2H4)。生成粗肼反应的化学方程式为_______________。
②火箭发射时可用肼(N2H4)为燃料,二氧化氮作氧化剂,生成无毒害的物质,写出反应方程式 _______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com