
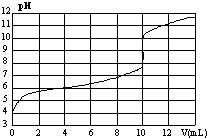
 室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是
室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是| A. | HA的浓度为1×10-4mol•L-1 | B. | 实验时可选甲基橙作指示剂 | ||
| C. | pH=7时,溶液中c(Na+)>c(A-) | D. | V=10mL,酸碱恰好中和 |
分析 A.HA是弱酸,不完全电离,结合图象判断氢离子浓度,然后分析HA的浓度大小;
B.氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂;
C.根据溶液中的电荷守恒判断;
D.由图象可知,当V=10mL,酸碱恰好中和.
解答 解:A.由图象分析可知,c(H+)=1×10-4mol•L-1,由于HA是弱酸,不完全电离,所以HA的浓度为大于1×10-4mol•L-1,故A错误;
B.氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂,不能选择甲基橙,应选择酚酞指示剂,故B错误;
D.pH=7时,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(A-),故C错误;
D.由图象可知,当V=10mL曲线出现飞跃,说明酸碱恰好中和,故D正确;
故选D.
点评 本题考查酸碱混合的定性判断和计算,题目难度中等,本题注意把握弱电解质的电离特点,易错点为D,注意酸碱中和滴定的实验原理,试题培养了学生灵活应用基础知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大判小的顺序;Z>R>Y>W | |
| B. | X与Y形成化合物中一定含有离子键,可能含有共价键 | |
| C. | Y的氢化物比R的氢化物稳定,但Y的氢化物比R的氢化物熔沸点低 | |
| D. | RY2、WY2通入BaCl2溶液中均有白色沉淀生成. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
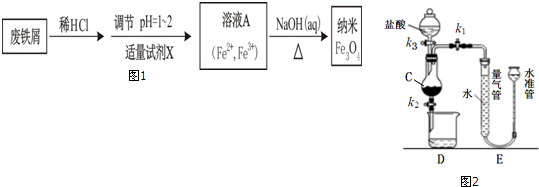
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
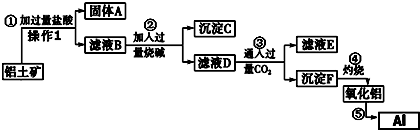
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中c(OH-) 增大 | |
| B. | 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小 | |
| C. | 通入少量HCl气体,溶液中c(NH4+)增大 | |
| D. | 降低温度,促进NH3•H2O电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③②④ | C. | ②①④③ | D. | ①④②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
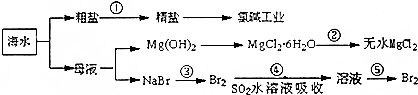
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | A | B→C化学方程式 |
| ① | ||
| ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com