
(13分)化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO 还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
【 已知:pH=-lgc(H+),常温下,水溶液中c(H+)×c(OH-)=10-14 】
①N2的结构式为________。
②请补充离子方程式,并进行配平:上述反应离子方程式为(配平为1不省略)
( )NO +( )H2 催化剂 ( )N2+( )H2O+( )__________,
+( )H2 催化剂 ( )N2+( )H2O+( )__________,
其平均反应速率v(NO )= mol·L-1·min-1。
)= mol·L-1·min-1。
(2)电化学降解NO 的原理如图所示。
的原理如图所示。
①电源正极为________(填“A”或“B”),
阴极反应式为 。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
(1)①N≡N (2分)
②2NO3?+5H2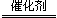 N2+2OH?+4H2O (3分,配平全对的2分,OH?对的1分) 0.001 (2分)
N2+2OH?+4H2O (3分,配平全对的2分,OH?对的1分) 0.001 (2分)
(2)① A (2分)2NO3?+6H2O+10e?=N2↑+12OH? (3分)
②14.4 (3分)
【解析】
试题分析:(1)①N2分子内N原子间形成了氮氮三键,所以结构式为:N≡N。
②根据原子守恒和电荷守恒,生成物还有OH?,根据化合价变化,N元素由+5价降低为0价,以N2为研究对象,共降低10价,H2中H元素由0价升高至+1价,共升高2价,根据化合价升高和降低的价数相等,配平可得离子方程式:2NO3?+5H2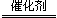 N2+2OH?+4H2O;根据pH=-lgc(H+),pH由7变为12,则溶液中H+浓度由10-7变为10-12,根据水溶液中c(H+)×c(OH-)=10-14 ,可得?c(OH?)=0.01mol?L?1,则v(NO)=0.01mol?L?1÷10min=0.001 mol·L-1·min-1。
N2+2OH?+4H2O;根据pH=-lgc(H+),pH由7变为12,则溶液中H+浓度由10-7变为10-12,根据水溶液中c(H+)×c(OH-)=10-14 ,可得?c(OH?)=0.01mol?L?1,则v(NO)=0.01mol?L?1÷10min=0.001 mol·L-1·min-1。
(2)①电解池的右侧NO3?转化为N2,N元素得电子发生还原反应,则Ag—Pt为电解池的阴极,B为电源的负极,所以电源正极为A;阴极发生NO3?得电子生成N2,根据化合价和电子转移、原子守恒、电荷守恒可得电极反应式为:2NO3?+6H2O+10e?=N2↑+12OH?
②电解池的左侧发生反应:2H2O—4e?=4H++O2↑,若电解过程中转移了2 mol电子,放出0.5mol O2,2mol H+通过质子交换膜移向右侧,左侧电解质溶液质量减少:0.5mol×32g/mol+2mol×1g/mol=18g,电解池的右侧发生反应:2NO3?+6H2O+10e?=N2↑+12OH?,若电解过程中转移了2 mol电子,放出0.2mol N2,从左侧进入2g H+,所以右侧电解质溶液质量减少:0.2mol×28g/mol—2g=3.6g,则膜两侧电解液的质量变化差(Δm左-Δm右)为:18g—3.6g=14.4g。
考点:本题考查物质的结构与性质、方程式的书写、电解原理及相关计算。


科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
容器中发生一个化学反应,反应过程中存在H2O、H2S、S、NH4+、H+、NO3—六种物质。在反应过程中测得NO3—和S的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是

A.配平后氧化剂与还原剂的化学计量数之比为1:4
B.硫元素在反应中被还原
C.还原剂是含NH4+的物质
D.若生成1molNH4+,则转移电子2mol。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
下列化学用语正确的是
A.Mg2+的电子式:
B. 甲烷的比例模型:
C.已知Ni与Co的化合价均只有+2和+3,则在Ni0.25Co0.75(OH)2中Ni的化合价是+2
D.聚氯乙烯的结构简式:
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合4 题型:简答题
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺,将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为2CuFeS2+ 2SiO2+5O2=2Cu+2FeSiO3+4SO2该反应的氧化剂是 。
(2)下列处理SO2的方法,不合理的是_____
A高空排放 B用纯碱溶液吸收制备亚硫酸钠
C用氨水吸收后,再经氧化制备硫酸铵 D用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO、Fe2O3、SiO2、Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中,未涉及到的操作有 。
A过滤 B加过量NaOH溶液 C蒸发结晶 D灼烧 E加氧化剂
II. FeCl3溶液浸取工艺其生产流程如下图所示

(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为_____________。
(5)该工艺流程中,可以循环利用的物质是 (填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时,溶液中Pb2+物质的量浓度为 mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合2 题型:简答题
CuCl2溶液中的铜主要以Cu(H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:

(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为___。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测甲电极附近溶液的pH=a,此时甲电极附近溶液中c(Cu2+)=______ mol·L-1。(已知:Cu(OH)2的Ksp=2.2×10-20)
(5)电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将I2氧化为IO3-,该反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )

A.铁是阳极,电极反应为Fe-6e-+4H2O===FeO+8H+
B.镍电极上的电极反应为2H2O+2e-==H2↑+2OH-
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
B.向煤中加入生石灰可减少对大气的污染
C.完全由非金属元素组成的化合物可以形成离子化合物
D.由氮气为原料合成氨是氮的固定
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:填空题
(16分)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
(1)写出CO2与H2反应生成CH4和H2O的热化学方程式 。
已知: ① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)另一生成CH4的途径是CO(g)+3H2(g) CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。

①该反应的△H 0(填“<”、“=”或“>”)。
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由________________________。
③某温度下,将0.1 mol CO和0.3 mol H2充入10L的密闭容器内发生反应CO(g)+3H2(g)  CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版4.1硅 无机非金属材料练习卷(解析版) 题型:选择题
在①浓硝酸;②水;③浓硫酸;④氢氟酸;⑤氢氧化钾溶液中,能与单质硅起化学反应的是( )。
A.①② B.②④ C.④⑤ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com