
分析 (1)加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,导致固体质量减少,根据固体质量减少,利用差量法计算每一份中碳酸氢钠的质量,混合物与盐酸反应生成6.72L为二氧化碳体积,根据碳元素守恒计算每一份混合物中n(Na2CO3),进而计算原混合物中含有Na2CO3的物质的量;
(2)再根据m=nM计算每一份中Na2CO3的质量,进而计算Na2CO3、NaHCO3的质量比.
解答 解:(1)混合物加热,质量减少:67.2g÷2-27.4g=6.2g
设混合物每一份中NaHCO3的质量的质量为m,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ 固体质量减少
168 62
m 6.2g
m=$\frac{168×6.2g}{62}$=16.8g
每一份中碳酸氢钠物质的量为:$\frac{16.8g}{84g/mol}$=0.2mol,
则原混合物中含有碳酸氢钠的物质的量为:0.2mol×2=0.4mol,
故答案为:0.4mol;
(2)每一份与盐酸反应,生成二氧化碳为:$\frac{6.72L}{22.4L/mol}$=0.3mol,根据碳元素守恒,每一份中n(Na2CO3)=0.3mol-0.2mol=0.1mol,
则Na2CO3、NaHCO3的质量比为:0.1mol×106g/mol:16.8g=53:84,
故答案为:53:84.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握差量法在化学计算中的应用方法,试题培养了学生达到分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题

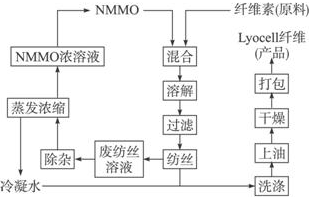
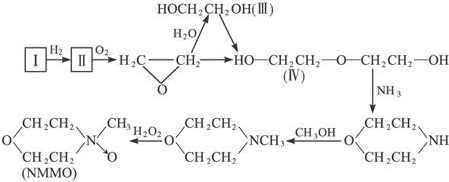
 .
.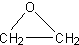 .
.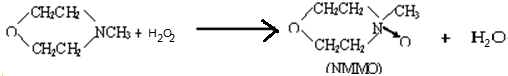 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钋原子的核外电子数是16 | |
| B. | 钋(Po)-210原核内中子数与质子数之差是42 | |
| C. | 钋是金属元素,最外层电子数小于4 | |
| D. | 钋元素的相对原子质量是210 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
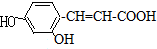 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
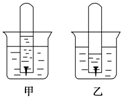 如图是铁钉在某溶液中被腐蚀的实验(开始时试管中液面和试管外液面等高).
如图是铁钉在某溶液中被腐蚀的实验(开始时试管中液面和试管外液面等高).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
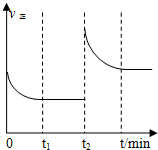 一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为:
一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
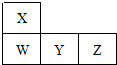
| A. | 元素Y位于元素周期表的第三周期ⅥA族 | |
| B. | 原子半径的大小顺序为:rW>rY>rZ | |
| C. | 元素Y的最高价氧化物对应水化物的酸性比Z的强 | |
| D. | 元素W的气态简单氢化物的热稳定性比X的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH+H2O$→_{△}^{HgSO_{4}}$CH3CHO | |
| B. | C2H5Br+H2O$→_{△}^{NaOH}$C2H5OH+HBr | |
| C. | CaC2+2H2O→Ca(OH)2+C2H2↑ | |
| D. | CH3COOCH3+H2O$→_{△}^{催化剂}$CH3COOH+CH3OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com