
分析 (1)氯化亚铁和氯气反应生成氯化铁,可向氯化亚铁溶液中通入氯气除去杂质氯化亚铁;
(2)碳酸氢钠与NaOH溶液反应生成碳酸钠和水,结合离子方程式的书写要求解答.
解答 解:(1)杂质为FeCl2,可向溶液中通入氯气除去FeCl3中的FeCl2,反应的离子反应为:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:Cl2;2Fe2++Cl2═2Fe3++2Cl-;
(2)碳酸氢钠与NaOH溶液反应生成碳酸钠和水,则试剂为NaOH溶液、发生的离子反应为:HCO3-+OH-=CO32-+H2O,
故答案为:NaOH溶液;HCO3-+OH-=CO32-+H2O.
点评 本题考查混合物分离提纯方法的选择和应用,把握物质的性质、性质差异、发生的化学反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
 “化学--人类进步的关键”.化学在生产生活中有着广泛的运用,尤其是化学反应原理.人们平时所用的铁及其化合物都跟化学有关.
“化学--人类进步的关键”.化学在生产生活中有着广泛的运用,尤其是化学反应原理.人们平时所用的铁及其化合物都跟化学有关.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向0.10mol•L-1氨水中通SO2:c(NH4+)+c(NH3•H2O)═c(HSO3-)+c(SO32-)+c(H2SO3) | |
| B. | 向0.10mol•L-1KHSO3溶液中通NH3:c(K+)>c(SO32-)>c(NH4+) | |
| C. | 向0.10mol•L-1NH4HS溶液中通H2S:c(NH4+)═c(S2-)+c(HS-) | |
| D. | 向0.10mol•L-1Na2C2O4溶液中通HCl:c(Cl-)═c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
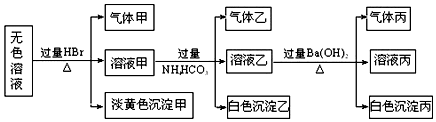
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
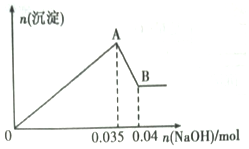 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.
某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O是中子数相同 | B. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O互为同位素 | ||
| C. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O化学性质不相同 | D. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O互为同素异形休 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
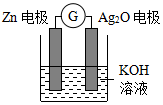 银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )
银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )| A. | Zn电极是负极 | |
| B. | Ag2O电极上发生还原反应 | |
| C. | Zn电极的电极反应式:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 放电前后电解质溶液的pH保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com