
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是____________。
(2)步骤Ⅱ吸收Br2,有关反应的化学方程式为___________________________,由此反应可知,除环境保护外,在工业生产中还应解决的主要问题是_________________。
(3)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了装置简图:

请你参与分析讨论:
①图中仪器B的名称是____________________。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?____。
【答案】 富集溴元素 Br2+SO2+2H2O=H2SO4+2HBr 强酸对设备的严重腐蚀 冷凝管 控制温度计b的温度,并收集59℃时的馏分
【解析】通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应Br2+SO2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2,结合流程图、装置图和问题解答。
(1)海水中溴元素含量较少,步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素;
(2)在水溶液里溴和二氧化硫反应化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,由此反应可知,生成物为强酸,所以除环境保护外,在工业生产中应解决的主要问题是如何防止强酸对设备的严重腐蚀;
(3)①图中仪器B的名称是冷凝管;
②实验装置气密性良好,要达到提纯溴的目的,操作中控制的关键条件是:控制温度计b的温度,并收集59℃的馏分,温度过高或过低都不利于溴的收集。


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) ⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是( )
A. ⊿H1>⊿H2>⊿H3 B. ⊿H1<⊿H3<⊿H2 C. ⊿H1<⊿H2<⊿H3 D. ⊿H1>⊿H3>⊿H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.请根据有关知识,填写下列空白:
(1)下列反应中,属于吸热反应的是______(填数字序号,下同),属于放热反应的是______。
①煅烧石灰石制生石灰②氢氧化钠固体溶于水 ③碳与水蒸气的反应 ④酸碱中和反应⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)已知H2和O2反应放热,且断开1molH-H、1mo1O=O、1molO-H键需要吸收的能量分别为Q1kJ、Q2kJ、Q3kJ,由此可以推知下列关系正确的是______(填字母编号)。
A. Q1+ Q2> Q3 B. 2Q1+ Q2<4 Q3 C. Q1+Q2>2Q3 D. 2Q1+Q2<2Q3
II.下列物质:①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧ I2
(1)只存在非极性键的是_____(用序号填空,下同)
(2)既含有共价键又含有离子键的是______________.
(3)当其熔化时,不破坏化学键的是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 三氯化铁对铜(Cu)说:尽管你不活泼,但我还是会包溶你。
(1)写出FeCl3溶液包溶铜板的离子方程式:______________________。
(2)若将(1)中的反应设计成原电池,写出电极反应式。
正极反应: _________________________________________;
负极反应:__________________________________________。
II. 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol/L的H2SO4溶液中,乙同学将电极放入6 mol/L的NaOH溶液中,如图所示。
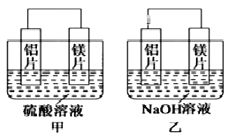
(1)甲中SO42-移向____(填“铝片”或“镁片”),写出甲中正极的电极反应式__________。
(2)乙中负极为______(填“铝片”或“镁片”)总反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800℃时在2L密闭容器内反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)达平衡时NO的转化率_________________。
(2)下图中表示NO2的变化的曲线是________,用O2表示从0~2s内该反应的平均速率v(O2)=____________。

(3)能说明该反应一定达到平衡状态的是_____________。
a.v(NO2)=2v(O2) b.容器内颜色保持不变
c.2v逆(NO)=v正(O2) d.容器内压强保持不变
(4)能增大该反应的反应速率的是___________________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
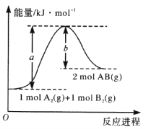
A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A. Cu2+是H2O2分解反应的催化剂 B. H2O2只表现了氧化性
C. H2O2的电子式为: ![]() D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期数与主族序数相等。
请回答下列问题:
![]()
(1)W在周期表中的位置是___________________________________,Q、R、T三种元素原子半径由大到小的顺序为________________________________。(用元素符号表示),
(2)QO2的电子式为_______________,R的最高价氧化物的化学式___________。
(3)T单质与NaOH 溶液反应的离子方程式为______________________
(4)T单质与W最高价氧化物的水化物溶液反应的离子方程式为_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com