


 £»
£»·ÖĪö ÓėĀČĘų·“Ӧɜ³ÉB£ØCH2=CHCH2Cl£©£¬øĆ·“Ó¦ĪŖČ”“ś·“Ó¦£¬ŌņAµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH2=CHCH3£¬BÓėMgŌŚĪŽĖ®ŅŅĆŃĢõ¼žĻĀ·“Ӧɜ³ÉC£ØCH2=CHCH2MgCl£©£¬DÓėBr2·¢Éś¼Ó³É·“Ӧɜ³ÉE£¬ŌņDµÄ½į¹¹¼ņŹ½ĪŖCH2=CHCH2CH£ØOH£©CH2OH£¬½įŗĻĢāÄæøųÓčµÄ·“Ó¦ŌĄķæÉÖŖ£¬ÓŠ»śĪļXĪŖHOCH2CHO£¬¶Ō±ČE”¢FµÄ½į¹¹¼ņŹ½æÉÖŖE·Ö×Ó·Ö×ÓÄŚČ”“ś·“Ó¦ĶŃČ„1·Ö×ÓHBrÉś³ÉF£¬F·¢ÉśĀ±“śĢžµÄĻūČ„·“Ӧɜ³ÉG£¬ŅŌ“Ė½ā“šøĆĢā£®
½ā“š ½ā£ŗ£Ø1£©Óɽį¹¹¼ņŹ½æÉÖŖFµÄ·Ö×ÓŹ½ĪŖC5H9O2Br£¬Ļą¶Ō·Ö×ÓÖŹĮæĪŖ181£¬Ōņ×ī“óÖŹŗɱȵďżÖµŹĒ181£¬¹Ź“š°øĪŖ£ŗ181£»
£Ø2£©·“Ó¦¢Ū·¢ÉśĀ±“śĢžµÄĻūČ„·“Ӧɜ³ÉG£¬·“Ó¦Ģõ¼žĪŖĒāŃõ»ÆÄʵē¼ČÜŅŗ”¢¼ÓČČ£¬ĖłŠčŅŖµÄŹŌ¼ĮĪŖĒāŃõ»ÆÄĘ“¼ČÜŅŗ£¬·“Ó¦¢ŚĪŖČ”“ś·“Ó¦£¬
¹Ź“š°øĪŖ£ŗNaOH“¼ČÜŅŗ£»Č”“ś·“Ó¦£»
£Ø3£©ÓŠ»śĪļBÖŠĖłŗ¬¹ŁÄÜĶŵÄĆū³ĘŹĒ£ŗĢ¼Ģ¼Ė«¼ü”¢ĀČŌ×Ó£¬
¹Ź“š°øĪŖ£ŗĢ¼Ģ¼Ė«¼ü”¢ĀČŌ×Ó£»
£Ø4£©ÓŠ»śĪļXµÄ½į¹¹¼ņŹ½ĪŖ£ŗHOCH2CHO£¬
¹Ź“š°øĪŖ£ŗHOCH2CHO£»
£Ø5£©ÓÉEµ½FµÄ»Æѧ·½³ĢŹ½£ŗ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£»
£Ø6£©AĪŖCH2=CHCH3£¬CŌ×Ó“Ó×óµ½ÓŅŅĄ“Ī±ąŗÅĪŖ¢Ł”¢¢Ś”¢¢Ū£¬ŌņClŌ×ÓµÄæÉÄÜĪ»ÖĆÓŠ¢Ł¢Ł”¢¢Ū¢Ū”¢¢Ł¢Ś”¢¢Ł¢Ū”¢¢Ś¢Ū”¢¹²5ÖÖ£¬¹Ź“š°øĪŖ£ŗ5£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļµÄĶʶĻÓėŗĻ³É£¬×¢Ņāøł¾ŻÓŠ»śĪļµÄ½į¹¹Óė·“Ó¦Ģõ¼ž½ųŠŠ·ÖĪö£¬³ä·Öæ¼²éĮĖѧɜµÄ·ÖĪöĄķ½āÄÜĮ¦¼°Įé»īÓ¦ÓĆĖłŃ§ÖŖŹ¶µÄÄÜĮ¦£¬×¢ŅāÕĘĪÕ¹ŁÄÜĶŵĊŌÖŹÓė×Ŗ»Æ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | ×óŹŅÖŠNaOHµÄÅØ¶Č²»±ä | |
| B£® | ¹¤×÷Ź±£¬OH-Ļņ×óĒØŅĘ | |
| C£® | ÓŅŹŅµē¼«·“Ó¦ĪŖC2H5OH+5OH--4e-=CH3COO-+4H2O | |
| D£® | ÓŅŹŅÉś³ÉCH3COONa1.5mol£¬ĄķĀŪÉĻ×óŹŅÉś³ÉĒāĘų67.2L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 12 | B£® | 13 | C£® | 14 | D£® | 15 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
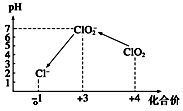 ¶žŃõ»ÆĀČŹĒŅ»ÖÖ»ĘĀĢÉ«µ½³Č»ĘÉ«µÄĘųĢ壬±»¹ś¼ŹÉĻ¹«ČĻĪŖ°²Č«”¢µĶ¶¾µÄĀĢÉ«Ļū¶¾¼Į£¬½ü¼øÄźĪŅ¹śÓĆClO2“śĢęĀČĘų¶ŌŅūÓĆĖ®½ųŠŠĻū¶¾£®
¶žŃõ»ÆĀČŹĒŅ»ÖÖ»ĘĀĢÉ«µ½³Č»ĘÉ«µÄĘųĢ壬±»¹ś¼ŹÉĻ¹«ČĻĪŖ°²Č«”¢µĶ¶¾µÄĀĢÉ«Ļū¶¾¼Į£¬½ü¼øÄźĪŅ¹śÓĆClO2“śĢęĀČĘų¶ŌŅūÓĆĖ®½ųŠŠĻū¶¾£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
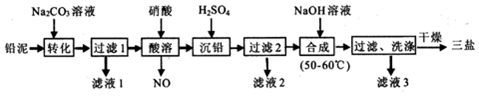
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| ½šŹōĄė×Ó | Fe3+ | Al3+ | ZrO2+ |
| æŖŹ¼³ĮµķµÄpH | 1.9 | 3.3 | 6.2 |
| ³ĮµķĶźČ«µÄpH | 3.2 | 5.2 | 8.0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com