
| A. | 元素X分别与Y、Z、R可以形成多种二元共价化合物 | |
| B. | 元素Y、Z、R形成的化合物的水溶液可能呈酸性、碱性或者中性 | |
| C. | 热稳定性:XmY强于XmR,沸点:XmY高于XmR | |
| D. | 五种元素的单质在常温下有两种是气态、两种是固态、一种是液态 |
分析 X、Y、Z、W、R 5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,则X为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,而Z、W、R处于同一周期,应为第三周期,原子序数W大于Z,故Z为Na,W为Al元素,据此解答.
解答 解:根据以上分析,X为H,Y为O,Z为Na,W为Al,R为S
A.X与Z形成NaH属于离子化合物,故A错误;
B.元素Y、Z、R形成的化合物可能为亚硫酸钠、硫代硫酸钠和硫酸钠,亚硫酸钠、硫代硫酸钠溶液为强碱弱酸盐呈碱性,硫酸钠溶液呈中性,所以没有呈酸性,故B错误;
C.因为Y的非金属性大于R,所以热稳定性:XmY强于XmR,又水分子之间存在氢键,故沸点XmY高于XmR,故C正确;
D.五种元素的单质在常温下有氢气、氧气两种是气态,Na、Al、S三种固态,故D错误,
故选C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,难度中等,注意氢键对物质性质的影响.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | a% | B. | 1-1.75% | C. | 4(l-a%)7 | D. | 3(l-a%)7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
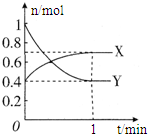 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| t/s | 0 | 50 | 150 | 250 | 350 |
| 总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用 1体积的乙醇与 3体积的浓 H2SO4混合加热到 140℃制乙烯 | |
| B. | 加入适量浓溴水除去苯中混有的少量苯酚 | |
| C. | 用饱和食盐水和电石(CaC2)制乙炔 | |
| D. | 以盐酸、石灰石、苯酚钠溶液为试剂,验证酸性强弱关系:盐酸>石炭酸>碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 |
| A | 除去铜器表面的铜绿[Cu2(OH)2CO3] | 用盐酸浸泡,再用清水冲洗 |
| B | 除去乙醇中的少量水 | 加生石灰,再蒸馏 |
| C | 除去氯化铁中含有少量氯化亚铁杂质 | 加入溴水 |
| D | 除去NaCl固体中的NH4Cl | 加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入硫酸酸化的NaCl溶液,生成白色沉淀,证明原溶液中含Ag+ | |
| B. | 向溶液中加入稀盐酸,生成使澄清石灰水变浑浊的无色无味气体,则原溶液中含CO32- | |
| C. | 向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中含SO42- | |
| D. | 溶液中加入HCl酸化后,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子大小介于10-9 m~10-7m之间的分散系称为胶体 | |
| B. | 电泳现象可证明胶体粒子带有电荷 | |
| C. | 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| D. | 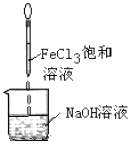 Fe(OH)3难溶于水,因此可以用如图的方法制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(K+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | B. | c(K+)+c(S2-)=0.3mol/L | ||
| C. | c(K+)=2[c(S2-)+c(HS-)+c(H2S)] | D. | c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com