
分析 (1)①根据盖斯定律将方程式I+II得NH3和CO2合成尿素总反应的热化学方程式,焓变进行相应的改变;
按照酸碱质子理论,能接受H+的物质为碱,根据接受H+的难易程度确定碱性强弱;
②化学反应速率与物质浓度成正比,物质浓度越大其化学反应速率越快;该反应的正反应是放热反应,升高温度平衡逆向移动,生成物浓度减小、反应物浓度增大;
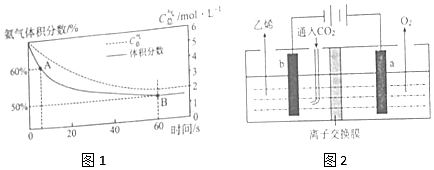
B点氨气的体积分数为50%,设参加反应的CO2物质的量浓度为xmol/L,
2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-87.00kJ•mol-1
开始 4 2 0
反应2x x x
平衡4-2x 2-x x
平衡时氨气体积分数等于其物质的量浓度分数=$\frac{4-2x}{4-2x+2-x+x}$×100%=50%,x=1;
催化剂降低反应所需活化能;
(2)①根据图知,a电极上电解水生成氧气和氢离子,b电极上二氧化碳得电子和氢离子反应生成乙烯和水;
②根据a电极生成氢离子、b电极需要氢离子,a电极产生的氢离子需要通过离子交换膜进入b电极分析.
解答 解:(1)①将方程式I+II得NH3和CO2合成尿素总反应的热化学方程式为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-87.00kJ•mol-1;
根据方程式知,反应中氨气接受氢离子生成铵根离子,按照酸碱质子理论,能接受H+的物质为碱,可根据接受H+的难易程度确定碱性强弱,所以氨气碱性强于NH2COONH4,
故答案为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-87.00kJ•mol-1;强于;
②化学反应速率与物质浓度成正比,物质浓度越大其化学反应速率越快,A点氨气体积分数大于B点,说明A点氨气浓度大于B点,所以反应速率v正(A)>v逆(B);该反应的正反应是放热反应,升高温度平衡逆向移动,生成物浓度减小、反应物浓度增大,所以化学平衡常数减小;
B点氨气的体积分数为50%,设参加反应的CO2物质的量浓度为xmol/L,
2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)
开始 4 2 0
反应 2x x x
平衡 4-2x 2-x x
平衡时氨气体积分数等于其物质的量浓度分数=$\frac{4-2x}{4-2x+2-x+x}$×100%=50%,x=1,则在B点氨气的转化率为:$\frac{1mol×2}{4mol-2mol}$×100%=50%,
催化剂减小反应所需活化能,
故答案为:>; 逐渐减小;50%;减小;
(2)①根据图知,a电极上电解水生成氧气和氢离子,b电极上二氧化碳得电子和氢离子反应生成乙烯和水,b电极上的电极反应式为:2CO2+12e-+12H+=C2H4+H2O,
故答案为:2CO2+12e-+12H+=C2H4+H2O;
②a电极生成氢离子、b电极需要氢离子,所以a电极产生的氢离子需要通过离子交换膜进入b电极,所以该装置中使用的是阳离子交换膜,
故答案为:阳.
点评 本题考查较为综合,涉及化学平衡的计算、反应热与焓变的应用、电解原理等知识,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题

| A. | NaHA的电离方程式为NaHA?Na++HA- | B. | B点:c(H2A)+c(H+)=c(OH-)+c(A2-) | ||
| C. | C点:c(Na+)=c(A2-)+c(HA-) | D. | D点:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 4 | 10 | 1 | 25 |
| 反应后的质量/g | 未测定 | 21 | 10 | 9 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
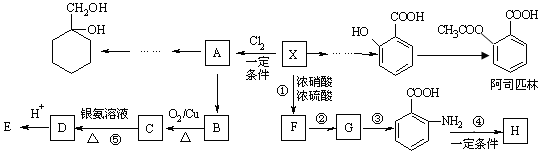

 ,反应①~⑤中属于取代反应的有①.
,反应①~⑤中属于取代反应的有①. .
.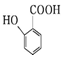 有多种同分异构体,请写出符合下列条件的同分异构体的结构简式
有多种同分异构体,请写出符合下列条件的同分异构体的结构简式 (或
(或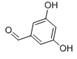 )(任写一种)
)(任写一种)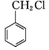 和其他无机试剂合成
和其他无机试剂合成 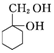 最合理的方案.
最合理的方案.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02 mol•L-1醋酸与0.02 mol•L-1NaOH等体积混合后的溶液中加少量的CH3COONa固体,则$\frac{c(C{H}_{3}CO{O}^{-})}{C(N{a}^{+})}$ 增大 | |
| B. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$ 的值及SO2转化率不变 | |
| C. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | lmol该化合物( 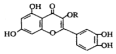 )与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4mol、8mol )与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4mol、8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 名称 | 250mL容量瓶 | 分液漏斗 | 酸式滴定管 | 冷凝管 |
| 图形 |  |  |  | 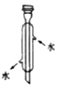 |
| 操作 | 定容时仰视刻度, 则配得的溶液浓 度偏小 | 用酒精萃取水中 碘从上倒出 | 可用于量取 Na2CO3溶液 | 蒸馏实验中将 蒸气冷凝为液体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | ① | ② | 实验现象 | 结论 | |
 | A | 铜丝 | 稀硝酸 | ②中出现红棕色气体 | 稀硝酸与铜生成了NO2 ③中需要碱溶液吸收尾气 |
| B | 铜丝 | Fe2(SO4)3溶液 | ②中溶液黄色变浅 | Cu与Fe2(SO4)3溶液 发生置换反应 | |
| C | 铁丝 | 饱和 食盐水 | ③中导管内液面上升 | 铁钉发生吸氧腐蚀 | |
| D | 铁丝 | 浓硫酸 | 无明显现象 | 铁与浓硫酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应表明拆开N-C键比N-N键容易 | B. | 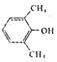 属于芳香醇的异构体有5种 属于芳香醇的异构体有5种 | ||
| C. | PHAC是一种酸式盐 | D. | PHAC能用于制造高能炸药 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com