
【题目】方程式书写:
(1)S+Ca(OH)2—CaS5+CaS2O3+H2O___。
(2)H2O2+Cr2(SO4)3+ —K2SO4+K2CrO4+H2O___。
(3)氯酸镁加入含有KSCN的酸性硫酸亚铁溶液中立即出现红色,写出相关反应的离子方程式___。
(4)写出用氯化铁溶液浸取辉铜矿石(主要成分是Cu2S)发生反应的离子方程式___。
【答案】12S+3Ca(OH)2=2CaS5+CaS2O3+3H2O 3H2O2+Cr2(SO4)3+10KOH=3K2SO4+2K2CrO4+8H2O ClO3-+6Fe2++6H+═6Fe3++Cl-+3H2O、Fe3++3SCN-═Fe(SCN)3 Cu2S+4Fe3+=2Cu2++4Fe2++S
【解析】
(1)在S+Ca(OH)2—CaS5+CaS2O3+H2O中硫元素从0价降为-![]() 价,从0价升高为+2价,则根据电子守恒可知12S+3Ca(OH)2=2CaS5+CaS2O3+3H2O;
价,从0价升高为+2价,则根据电子守恒可知12S+3Ca(OH)2=2CaS5+CaS2O3+3H2O;
(2)在H2O2+Cr2(SO4)3+ —K2SO4+K2CrO4+H2O中H2O2中氧元素从-1价降为-2价,Cr元素从+3价升高为+6价,结合电子守恒和原子守恒得发生反应的化学方程式为3H2O2+Cr2(SO4)3+10KOH=3K2SO4+2K2CrO4+8H2O;
(3)Mg(ClO3)2加入到含有KSCN的FeSO4酸性溶液中立即出现红色,说明氯酸根离子在酸性溶液中具有氧化性,能氧化亚铁离子为铁离子,本身被还原为氯离子,结合电荷守恒和原子守恒写出反应的离子方程式为:ClO3-+6Fe2++6H+═6Fe3++Cl-+3H2O、铁离子遇到KSCN溶液变红色,反应的离子方程式为:Fe3++3SCN-═Fe(SCN)3;
(4)FeCl3氧化Cu2S所得氧化产物为S和Cu2+,还原产物为Fe2+,发生反应的离子方程式为Cu2S+4Fe3+=2Cu2++4Fe2++S。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为:C2H5OH+3O2===2CO2+3H2O,电池构造如下图所示。下列关于该电池的说法正确的是( )

A.放电过程中,电源内部的H+从正极区向负极区迁移
B.通入乙醇的电极是正极
C.该电池的正极反应为:4H++O2+4e-===2H2O
D.用该电池做电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2 mol C2H5OH,阴极产生标准状况下气体的体积为13.44 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.向氯化钡溶液中通入少量SO2:Ba2++SO2+H2O=BaSO3↓+2H+
B.Fe(OH)3溶于HI:Fe(OH)3+3H+=Fe3++3H2O
C.大理石与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D.碳酸钠水解:CO![]() +H2O=HCO
+H2O=HCO![]() +OH-
+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氧体(Fe3O4)法是处理含废铬水的常用方法,其原理是用FeSO4把废水中Cr2O![]() 还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3FeO)的复合氧化物(
还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3FeO)的复合氧化物(![]() )。CrxFe2-xO3FeO处理含1molCr2O
)。CrxFe2-xO3FeO处理含1molCr2O![]() 废水至少需要加入amolFeSO47H2O。下列结论正确的是( )
废水至少需要加入amolFeSO47H2O。下列结论正确的是( )
A.x=0.5,a=10B.x=1,a=5C.x=2,a=l0D.x=0.5,a=8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性、高效催化性等优良的性质。
Ⅰ.实验室采用气相还原法制备纳米级Fe,其流程如图所示::
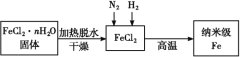
(1)纳米级Fe和稀盐酸反应的离子方程式为_____。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2:____(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为____。
Ⅱ.查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用图甲所示装置进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。

(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是_____。
(5)甲装置中仪器a的名称为_____。
(6)丁同学称取5.60gFe粉,用乙装置反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为_____(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:

已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分析正确的是( )
A.异丁烷的二氯代物有4种
B.误食少量硫酸铜,可大量饮入牛奶解毒
C.石蜡油分解产物均能使酸性KMnO4溶液褪色
D.CH3-CH=CH2中所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种“全氢电池”的工作原理如图所示。下列说法不正确的是
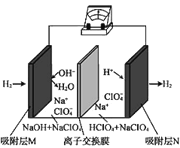
A.电子流向是从吸附层M通过导线到吸附层N
B.电池工作时,负极区pH减小
C.离子交换膜可用质子交换膜
D.负极的电极反应是:H2-2e-+2OH-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应A(s)+3B(g)![]() 2C(g),下列说法不能说明达到化学平衡状态的是
2C(g),下列说法不能说明达到化学平衡状态的是
A. 气体密度不再变化 B. 混合气体的总压强不再变化;
C. A、B、C的物质的量之比为1∶3∶2 D. 混合气体的平均相对分子质量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com