
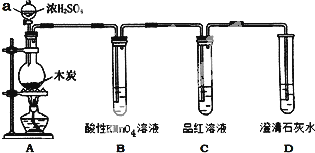
分析 碳和浓硫酸在加热条件下反应生成SO2和CO2,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾溶液用于吸收SO2,品红溶液用于检验SO2是否除干净.
(1)由图可知仪器a的名称,在组装好上述实验装置后,在装入药品之前必须检验装置的气密性;
(2)装置A中发生的反应为C和浓硫酸共热生SO2、CO2和水,以此写出化学方程式;
(3)酸性高锰酸钾具有强氧化性,可以氧化二氧化硫,因此用酸性高锰酸钾溶液吸收SO2;
(4)品红溶液不褪色,说明SO2除干净,澄清的石灰水变浑浊,即可说明产物中一定存在CO2气体.
解答 解:碳和浓硫酸在加热条件下反应生成SO2和CO2,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾溶液用于吸收SO2,品红用于检验SO2是否除干净.
(1)由图可知仪器a为分液漏斗,在组装好上述实验装置后,在装入药品之前必须检验装置的气密性,
故答案为:分液漏斗;检查装置的气密性;
(2)装置A中发生的反应为C和浓硫酸共热生SO2、CO2和水,化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾具有强氧化性,可以氧化二氧化硫,因此用酸性高锰酸钾溶液除掉SO2;
故答案为:除去混合气体中二氧化硫;
(4)品红溶液不褪色,说明SO2除干净,澄清的石灰水变浑浊,即可说明产物中一定存在CO2气体,
故答案为:C中品红不褪色,D中溶液出现白色沉淀.
点评 本题考查了浓硫酸的强氧化性,侧重于SO2和CO2性质的比较,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,为高频考点,有利于培养学生的良好的科学素养,提高学生学习实验的积极性,难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
某同学采用硫铁矿焙烧,取焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
下列说法不正确的是
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制p H是为了使Al3+转化为Al(OH)3,进入固体2
H是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7 H2O
H2O
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列有关“水”的说法中正确的是( )
A.双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境无污染
B.王水是浓盐酸和浓硝酸按体积比1∶3配成的混合物,可溶解Au、Pt
C.氨水能导电,说明氨气是电解质
D.往新制备的氯水中和SO2的水溶液中分别滴入石蕊试液时的现象不同
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
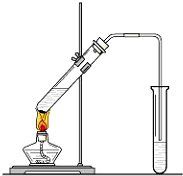 在实验室我们可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:
在实验室我们可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
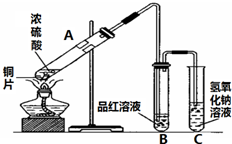 图是进行铜与浓硫酸反应并进行产物检验的装置.
图是进行铜与浓硫酸反应并进行产物检验的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
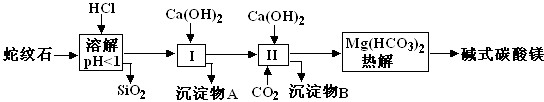
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.3 | 3.3 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com