
���� ��1����������ԭ��Ӧ��ʧ���ӵ���������ԭ�����õ��ӵ������������������������������ԡ���ԭ�����л�ԭ�ԣ�
��2������ת�Ƶ����غ����n��Cu��������Cuԭ���غ��������ͭ�����ʵ���������ͭ����=nM������ת�Ƶ����غ��������������������
��3����Һ�к�������ͭ�����ᣬ����ͭ�����ᶼ�ܺ�����������Ӧ�������ᱵ������
��� �⣺��1���÷�Ӧ�����Ը��������Һ����������������������ԭ������ԭ��ʧ���ӡ��������õ��ӣ����Ը÷�Ӧ��SO2ʧ���ӣ��ʴ�Ϊ��SO2��
��2������ת�Ƶ����غ���ܽ�n��Cu��=$\frac{0.2mol}{2}$=0.1mol������Cuԭ���غ��n��CuSO4��=n��Cu��=0.1mol������ͭ����=nM=0.1mol��160g/mol=16g������ת�Ƶ����غ�ö��������������=$\frac{0.2mol}{2}��22.4L/mol$=2.24L��
�ʴ�Ϊ��16��2.24��
��3����Һ�к�������ͭ�����ᣬ����ͭ�����ᶼ�ܺ�����������Ӧ�������ᱵ���������ӷ���ʽ�ֱ�ΪBa2++SO42-+2OH-+2H+=2H2O+BaSO4����Ba2++SO42-+2OH-+Cu2+=Cu��OH��2��+BaSO4����
�ʴ�Ϊ��Ba2++SO42-+2OH-+2H+=2H2O+BaSO4����Ba2++SO42-+2OH-+Cu2+=Cu��OH��2��+BaSO4����
���� ���⿼�黯ѧ����ʽ�йؼ��㡢���ӷ���ʽ��д�ǽⱾ��ؼ�����ȷ�����������Ĺ�ϵ�ǽⱾ��ؼ������ؿ���ѧ��֪ʶ�ۺ�Ӧ��������ע�⣨3������©д����ˮ��������ͭ�����ӷ���ʽ��Ϊ�״��㣮


 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�22.4LCO2������ԭ����Ϊ3NA | |
| B�� | 1molCl2��������Fe��ȫ��Ӧ��ת�Ƶĵ�����Ϊ2NA | |
| C�� | 0.5molC2H2��C6H6����̬�����������ԭ������Ϊ2NA | |
| D�� | 2L1mol/L������������HCl������ԼΪ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol/L�������0.1mol/L�İ�ˮ�������� | |
| B�� | pH=3�������pH=11������������Һ�������� | |
| C�� | pH=3�Ĵ����pH=11������������Һ�������� | |
| D�� | pH=3�������pH=11�İ�ˮ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl2 | B�� | NO | C�� | SO3 | D�� | CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
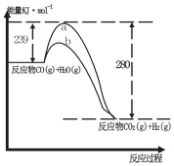 ��1����֪��25�棬101KPaʱ��1gH2��g����ȫȼ������Һ̬ˮʱ�ų�143KJ����������д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��2H2��g��+O2��g��=2H2O��1����H=-572kJ•mol-1
��1����֪��25�棬101KPaʱ��1gH2��g����ȫȼ������Һ̬ˮʱ�ų�143KJ����������д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��2H2��g��+O2��g��=2H2O��1����H=-572kJ•mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
| ��� | C��H2��mol/L | C��CO��mol/L |
| �� | 2 | 1 |
| �� | 1 | 2 |
| �� | 1 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������Ȼ���������ˮ����ɱ������ | |
| B�� | �ȵĴ�����Һ������ȥ���� | |
| C�� | �����к͵ζ�ԭ���ɲⶨNaOH��NaCl���Һ��NaCl�ĺ��� | |
| D�� | ���Ȼ��Ũ��Һ�ɳ�ȥ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com