
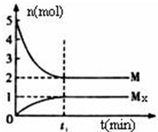
 E�Ƿǽ�������ǿ������Ԫ�أ�M��E����̬�⻯��ڹ̶�������ܱ������У�����M��������ת����ϵ��aM��g��?bMx��g������Ӧ�������������ʵ�����ʱ��ı仯��ϵ��ͼ������˵����ȷ���ǣ�������
E�Ƿǽ�������ǿ������Ԫ�أ�M��E����̬�⻯��ڹ̶�������ܱ������У�����M��������ת����ϵ��aM��g��?bMx��g������Ӧ�������������ʵ�����ʱ��ı仯��ϵ��ͼ������˵����ȷ���ǣ�������| A�� | ƽ��ʱ��������ƽ��Ħ��������33.3g/mol | |
| B�� | t1ʱ�̣������¶Ȳ��䣬�ٳ���5molM�����´ﵽƽ��ʱ��c��Mx��/c��M������С | |
| C�� | �÷�Ӧ�Ļ�ѧ����ʽ��2HF?��HF��2 | |
| D�� | M�ķе��ͬ������һ����Ԫ�ص���̬�⻯��е�� |
���� A��ƽ��ʱ��������ƽ��Ħ������=$\frac{��������������}{�������������ʵ���}$��
B���ٳ���5molM��ѹǿ������ѹǿ�Ի�ѧƽ���ƶ���Ӱ�����ش�
C��FԪ���Ƿǽ�������ǿ��Ԫ�أ�HF��F����̬�⻯��ݴ���ȷ����ѧ��Ӧ��
D��HF���Ӽ������������·е�ϸߣ�
��� �⣺A������ͼ��ƽ��ʱHF�ͣ�HF��3���ʵ����ֱ�Ϊ��2mol��1mol����������ƽ��Ħ������=$\frac{��������������}{�������������ʵ���}$=$\frac{20��2+20��3}{3}$=33.3g/mol����A��ȷ��
B��t1ʱ�̣������¶Ȳ��䣬�ٳ���5molM��ѹǿ����ѧƽ�������ƶ��������´ﵽƽ��ʱ��$\frac{c��M{\;}_{X}��}{c��M��}$������B����
C��FԪ���Ƿǽ�������ǿ��Ԫ�أ�HF��F����̬�⻯������Ļ�ѧ��ӦΪ��xHF��g��?��HF��x��g��������ͼ��HF�ͣ�HF��x���ʵ����仯��֮��=3��1=ϵ��֮�ȣ��÷�Ӧ�Ļ�ѧ����ʽ��3HF?��HF��3����C����
D����ΪHF���Ӽ����������е�ϸߣ���HCl���Ӽ䲻�������������HF�е����HCl����D����
��ѡA��
���� ������һ�����ڻ�ѧ��Ӧ���ʺͻ�ѧƽ��֪ʶ���ۺ���Ŀ�����ͼ�������飬�����˽�����Ѷȣ�


 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д� Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.2mol•L-1��ˮ�е���0.2mol•L-1CH3COOH��Һ���ܴ��ڣ�c��NH4+��-��CH3COO-����c��OH-��-c��H+�� | |
| B�� | pH=5.6��NaHSO3��Һ��c��Na+����c��HSO3-����c��H2SO3����c��SO32-�� | |
| C�� | ��BaSO4����Һ�м���Na2SO4���壬Ksp��BaSO4����С | |
| D�� | ��pOH=-lgc��OH-������pH=3��������pOH=3�İ�ˮ����������Һ��PH��7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�22.4L H2O�����ķ���������NA | |
| B�� | ��֪CH3COONH4��Һ��PH=7����1L 0.1mol/L��CH3COONH4��Һ�У�CH3COO- ��Ϊ0.1NA | |
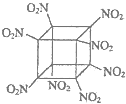
| C�� | ��ѧ�����Ƴ��İ����������飨�ṹ����ͼ��ʾ��̼ԭ��δ������1 mol�÷����к�8 mol�������� | |
| D�� | ��״���£�33.6L���ȼ����к�����ԭ�ӵ���ĿΪ3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Y��������Y 2-�Ļ�ԭ��ǿ��X��������X- | |
| B�� | X�ĺ���������Ա�Y�ĺ����������ǿ | |
| C�� | X�ĵ���X2�ܽ�Y��������Y 2-�������������û���Ӧ | |
| D�� | X���⻯���Y���⻯���ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȥ-ȡ��-�ӳ� | B�� | ȡ��-��ȥ-�ӳ� | C�� | ��ȥ-�ӳ�-ˮ�� | D�� | ˮ��-ȡ��-ȡ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 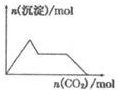 ��0.0l mol KOH��0.01 mol Ca��OH��2�Ļ����Һ�л���ͨ��CO2 | |
| B�� | 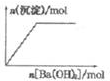 NaHSO4��Һ����μ���Ba��OH��2��Һ | |
| C�� | 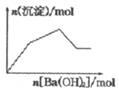 KAl��SO4��2��Һ����μ���Ba��OH��2��Һ | |
| D�� | 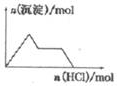 NaAlO2��Һ����μ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=2��HA��Һ��pH=12��MOH��Һ������Ȼ�ϣ�c��H+��+c��M+��=c��OH-��+c��A-�� | |
| B�� | pH=10��Na2A��Һ�У�2 c��Na+��=c��HA-��+c��H2A��+c��A2-�� | |
| C�� | �����ʵ���Ũ�ȵ�NaClO��NaHCO3�����Һ�У�c��HClO��+c��ClO-��=c��HCO3-��+c��H2CO3��+c��CO32-�� | |
| D�� | ��ˮ���Ȼ�淋Ļ����Һ�����ܻ����c��NH${\;}_{4}^{+}$����c��Cl-����c��H+����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
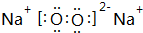 ��д��M2Z2��ˮ��Ӧ�����ӷ���ʽ��2Na2O2+2H2O=4Na++4OH-+O2����
��д��M2Z2��ˮ��Ӧ�����ӷ���ʽ��2Na2O2+2H2O=4Na++4OH-+O2�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O2�ĵ���ʽ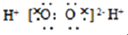 | |
| B�� | NH4I�ĵ���ʽ | |
| C�� | ԭ�Ӻ�����8�����ӵ�̼ԭ�ӣ�${\;}_{8}^{14}$C | |
| D�� | CO2���ӵĽṹʽ��O=C=O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com