
【题目】实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定CaC2样品的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。

(1)A瓶中的液体可以从酸性KMnO4溶液和FeCl3溶液中选择,应该选择________,它的作用是___________________________。
(2)装置Ⅰ的主要缺点是______________________________________。
(3)装置Ⅱ的主要缺点是_____________________;
若选用此装置来完成实验,则应采取的措施是___________________。
(4)若称取a g CaC2,反应完全后,测得B处溴水增重b g,则CaC2的纯度为________。
【答案】(1)FeCl3溶液 除去H2S、PH3等杂质气体
(2)部分乙炔会从长颈漏斗逸出,造成实验误差,且不易控制加水量
(3)反应产生的泡沫易堵塞导管 在装置的导管口加上一团棉花
(4) ![]() ×100%
×100%
【解析】A瓶中的液体是用来除去混在乙炔中的H2S、PH3,酸性KMnO4溶液会在除去H2S、PH3的同时也将C2H2氧化,故选用FeCl3溶液,装置Ⅰ和Ⅱ均可制乙炔,但装置Ⅰ的主要缺点为部分乙炔气体会从长颈漏斗口逸出,造成实验误差,且长颈漏斗也不易控制加水量。由于CaC2与水剧烈反应产生泡沫,故装置Ⅱ的缺点为泡沫易堵塞导管,可在装置的导管口加上一团棉花。实验时,B处溴水增加质量即为所吸收乙炔的质量,由题意则有:n(CaC2)=n(C2H2)=![]() mol,m(CaC2)=
mol,m(CaC2)=![]() mol×64 g/mol=
mol×64 g/mol=![]() g,CaC2的纯度=
g,CaC2的纯度=![]() ×100%。
×100%。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:![]()
(1)①反应类型______________
②反应类型________________
(2)现有如下有机物:
① CH3—CH3 ② CH2=CH2 ③ CH3CH2C![]() CH
CH
④ CH3C![]() CCH3 ⑤ C2H6 ⑥ CH3CH=CH2
CCH3 ⑤ C2H6 ⑥ CH3CH=CH2
一定互为同系物的是_______,一定互为同分异构体的是_______(填序号)
(3)人造羊毛的主要成分是聚丙烯腈(丙烯腈:CH2=CH—CN),试写出以乙炔、HCN为原料,两步反应合成聚丙烯腈的化学方程式。
①_________________________________
②_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则下列说法错误的是
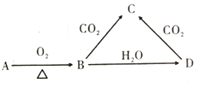
A.A与水反应可生成D
B.B常用于制作呼吸面具
C.C与澄清石灰水反应生成白色沉淀和D
D.将稀硫酸铝溶液逐滴滴入D溶液中,开始时就会产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d]在一定条件下的转化如图所示,下列说法正确的是( )

A. a、b、c、d符合关系式:a+b=c+d
B. X可能为NaOH
C. Q可能为NH3
D. 工业上用CO还原Al2O3的方法制取金属Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种易溶于水的物质,分别由 Ba2+、Mg2+、H+、OH-、Cl-、SO![]() 、 NH
、 NH![]() 、HCO
、HCO![]() 中不同阳离子和阴离子各一种组成,已知:①将甲溶液分别与其他三种 物质的溶液混合均有白色沉淀生成;②0.1 mol·L-1 乙溶液中 c(H+)=0.2 mol·L-1;③向丙溶液中滴入 AgNO3 溶液有不溶于稀硝酸的白色沉淀生成。下列结论不正确的是
中不同阳离子和阴离子各一种组成,已知:①将甲溶液分别与其他三种 物质的溶液混合均有白色沉淀生成;②0.1 mol·L-1 乙溶液中 c(H+)=0.2 mol·L-1;③向丙溶液中滴入 AgNO3 溶液有不溶于稀硝酸的白色沉淀生成。下列结论不正确的是
A.甲溶液中含有 Ba2+B.乙溶液中含有 SO![]()
C.丙溶液中含有 Cl-D.丁溶液中含有 Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL![]()
![]() 溶液中逐滴加入20mL
溶液中逐滴加入20mL![]() 的盐酸,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
的盐酸,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
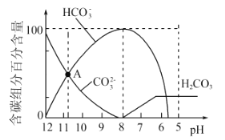
A.HCl溶液滴加一半时:![]()
B.在A点:![]()
C.当![]() 时:
时:![]()
D.当![]() 时,溶液中
时,溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物B是芳香烃的含氧衍生物,其相对分子质量不超过120,B中含氧的质量分数为14.8%,B与NaOH溶液不发生反应。有机物A在一定条件下可发生反应A+H2O![]() B+C。有关C的转化关系如下图所示:
B+C。有关C的转化关系如下图所示:
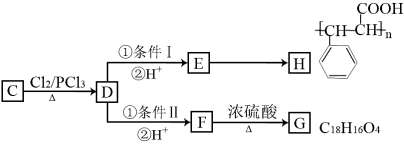
已知:![]()
根据以上信息,回答下列问题:
(1)B的结构简式为 ,条件I、II中均需要的试剂为 。
(2)有关C的转化关系图中所发生的反应中属于取代反应的有 个。
(3)C的同分异构体中,同时符合下列要求的物质有 种。
a.苯环上有两个侧链 b.能发生银镜反应 c.能发生消去反应
(4)写出G→F转化的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(Ⅱ)酸钾晶体![]() (其摩尔质量为354g·
(其摩尔质量为354g·![]() ),是一种工业用化工原料。微溶于冷水,微溶于酒精,虽可溶于热水但会慢慢分解,干燥时较为稳定,温度高于260℃易分解。现以胆矾和草酸钾晶体为原料制备二草酸合铜(Ⅱ)酸钾晶体流程如下:
),是一种工业用化工原料。微溶于冷水,微溶于酒精,虽可溶于热水但会慢慢分解,干燥时较为稳定,温度高于260℃易分解。现以胆矾和草酸钾晶体为原料制备二草酸合铜(Ⅱ)酸钾晶体流程如下:

根据以上内容请回答:
(1)冷却混合液时___________(“能”或者“不能”)用冰水加速冷却,原因是_________________
(2)下列说法正确的是_____________。
a.抽滤时选用的滤纸要小于布氏漏斗内径。且能盖住所有小孔
b.洗涤时可用冷水作洗涤剂
c.洗涤固体时,应开大水龙头,使洗涤过程快速完成
d.可以用加热烘干固体法,但加热温度不宜很高
(3)胆矾晶体可以从硫酸铜溶液中获得。具体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.___________________。
②在蒸发浓缩的初始阶段可通过_________(填操作名称)回收乙醇。
(4)准确称取制取的试样1.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入10mL3.000![]() 的
的![]() 溶液,用0.01000
溶液,用0.01000![]() 的
的![]() 溶液滴定,消耗
溶液滴定,消耗![]() 标准液18.00mL,则该产品的纯度是_____________。
标准液18.00mL,则该产品的纯度是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅铁合金广泛应用于冶金工业,可用于铸铁时的脱氧剂、添加剂等,回答下列问题:
(1)基态Fe原子价层电子的电子排布图为________,基态Si原子电子占据最高能级的电子云轮廓图为________形。
(2)绿帘石的组成为![]() ,将其改写成氧化物的形式为_____________.
,将其改写成氧化物的形式为_____________.
(3)![]() 分子的中心原子的价层电子对数为________,分子的立体构型为________;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________。
分子的中心原子的价层电子对数为________,分子的立体构型为________;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________。
|
|
|
| |
熔点/K | 182.8 | 202.7 | 278.5 | 393.6 |
沸点/K | 177.4 | 330.1 | 408 | 460.6 |
(4)![]() 可与乙二胺(
可与乙二胺(![]() ,简写为en)发生如下反应:
,简写为en)发生如下反应:![]()
![]() 。
。![]() 的中心离子的配位数为________;
的中心离子的配位数为________;![]() 中的配位原子为________。
中的配位原子为________。
(5)在硅酸盐中,![]() 四面体(图
四面体(图
|
|
图a | 图b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com