
【题目】下列说法正确的是( )
A. SO2 与 CO2 的分子立体构型均为直线形
B. H2O 和 NH3 中的中心原子杂化方式相同
C. CS2 为空间构型为 V 形的极性分子
D. HCN、SiF4 和 SO32- 的中心原子均为 sp3 杂化
科目:高中化学 来源: 题型:
【题目】“张亭栋研究小组”受民间中医启发,发现As2O3对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)为第VA族元素,该族元素的化合物在研究和生产中有着许多重要用途。
(1)N原子的价电子排布式为______,N、P、As原子的第一电离能由大到小的顺序为______。
(2)NH3的沸点比AsH3的沸点高,原因是____________。
(3)立方氮化硼晶体(BN),是一种超硬材料,有优异的耐磨性,其晶胞如图所示。

①立方氮化硼是_________晶体,晶体中N原子的杂化轨道类型为_________,A,B原子的配位数为_________。
②立方氮化硼晶体中“一般共价键”与配位键的数目之比为_________。
(4)若立方氮化硼晶胞的边长为362 pm,则立方氮化硼的密度为_________g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:

(1)实验室灼烧海藻,需要下列仪器中的_____(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)提取碘的过程中,可选择的有机试剂是____(填字母)。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸
(3)小组用CCl4萃取碘水中的碘,在如图的分液漏斗中,下层液体呈___色;他们打开分液漏斗下端的活塞,却未见液体流下,原因可能是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化剂及军事科学中。所谓“纳米材料”是指研究、开发出的微粒直径从几纳米到几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是________。
a.能全部透过滤纸
b.有丁达尔效应
c.所得液体呈胶状
d.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,鉴别溶液和淀粉胶体可以利用的方法是_______________。
Ⅱ.丁达尔效应是区分胶体与溶液的一种最常用的方法。
(1)如图所示是在实验室中进行Fe(OH)3胶体丁达尔效应实验的示意图,该图中有一处明显的错误是______,原因是____________(试从分散系的分类进行说明)。
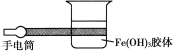
(2)欲在树林中观察丁达尔效应,你认为一天中最有可能观察到该现象的时间是________,理由是_________________。
(3)去树林观察丁达尔效应有诸多不便,聪明的你想出了许多在家里看到丁达尔效应的方法,请设计一个你认为最简单、最环保的方法:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下反应条件的控制中,不恰当的是( )
A.为加快H2O2的分解速率增大H2O2的浓度
B.为加快H2O2的分解速率而把反应容器放到冷水中冷却
C.为加快KClO3的分解速率而加入MnO2
D.为防止火灾,在面粉厂、加油站等场所要严禁烟火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用。
(1)C、N、O三种元素的第一电离能由大到小的顺序为___________。
(2)与N3-含有相同电子数的三原子分子的空间构型是___________。
(3)Cu+的核外电子排布式为___________,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu。但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O__________________。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是___________,乙醇的沸点明显高于乙醛,其主要原因为___________。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式___________。
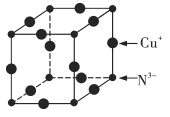
(6)Cu3N的晶胞结构如图所示,N3-的配位数为___________,Cu+的半径为apm,N3-的半径为bpm,Cu3N的密度为___________g·cm-3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线如下:(部分反应条件略去)
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线如下:(部分反应条件略去)
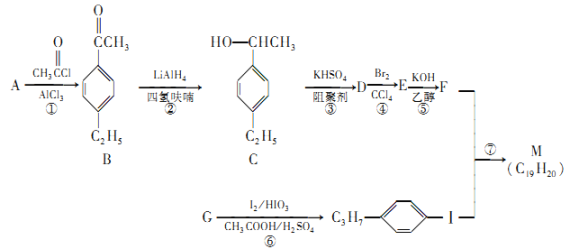
回答下列问题:
(1)A的名称为___________,G的分子式为___________。M中含有的官能团名称是___________。
(2)D分子中最多有___________个碳原子共平面。
(3)①的反应类型是___________,④的反应类型是___________。
(4)⑤的化学方程式为_________________________________。
(5)B的同分异构体中能同时满足如下条件:①苯环上有两个取代基,②能发生银镜反应,共有___________种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6︰2︰2︰1︰1的结构简式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学对于生活中流传的“吃菠菜补铁”之说产生兴趣,设计实验进行相关探究。检索文献表明,菠菜中的铁元素以草酸亚铁的形式存在,草酸亚铁是一种淡黄色难溶于水的晶体。
I.菠菜中铁元素含量的测定
(1)取100g洗净晾干的新鲜菠菜,切碎后装入___________中,放入烘箱烧成灰烬。
(2)将灰烬用25mL 2mol/L硫酸溶液溶解,加热煮沸一分钟,过滤后滴加适量H2O2溶液并稀释至100mL,取2mL加入5滴KSCN溶液。H2O2用量不可过大,否则溶液将先变红后褪色,褪色的原因是_________________________________。
(3)取不同浓度的___________[填“(NH4)2Fe(SO4)2”或“NH4Fe(SO4)2”]标准溶液各2mL,分别滴加5滴KSCN溶液,发现与步骤(2)中溶液颜色最接近的标准溶液浓度为0.4×10-3mol/L。
(4)经计算可得,每100g新鲜菠菜中含有铁元素的质量约为___________ mg(保留1位有效数字),按人体5%吸收率,为满足每日20mg的铁元素需求,每天需要吃菠菜___________kg。
Ⅱ.草酸亚铁晶体(FeC2O4·nH2O)的分解实验
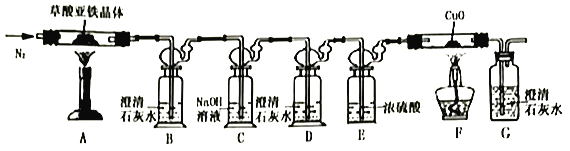
(1)从环保角度考虑,该套实验装置的明显缺陷是___________。
(2)实验开始后,装置B中出现浑浊证明分解产物中存在CO的现象是___________;将充分反应后的固体残余物投入经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色。
(3)称取7.2g草酸亚铁晶体放入装置A硬质玻璃管中,加热后(假设各步骤反应完全),测得装置A硬质玻璃管中残余固体2.88g,装置F硬质玻璃管中固体质量减轻0.64g,则草酸亚铁晶体分解的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1。某同学进行了如下实验:
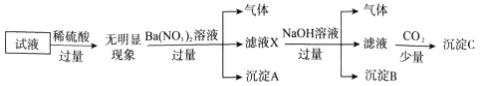
下列说法正确的是( )
A. 无法确定原试液中是否含有Al3+、Cl-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com