
下列各组实验现象可用同一原理解释的是
A.品红溶液中分别通入SO2和Cl2,品红均褪色
B.浓硫酸和浓盐酸长期暴露在空气中浓度都会降低
C.溴水分别滴入植物油和裂化汽油中,溴水均褪色
D.鸡蛋白溶液中分别加入NaCl溶液和CuCl2溶液,均有固体析出
【知识点】物质的性质
【答案解析】C 解析:A.SO2使品红溶液褪色是其与品红化合生成了无色的物质,Cl2使品红褪色是把品红氧化成无色的物质,褪色原理不同,错误;B.浓硫酸具有吸水性,暴露在空气中是吸收了空气中的水分而使浓度降低;浓盐酸具有挥发性,暴露在空气中HCl挥发而使溶液浓度都会降低,错误;C.溴水分别滴入植物油和裂化汽油中,都是与有机物发生了中的碳碳双键发生了加成反应,正确;D.鸡蛋白溶液中加入NaCl溶液是发生了盐析而有固体析出;加入CuCl2溶液是发生了变性而有固体析出,错误。
【思路点拨】本题考查了溶液褪色的原理、一些物质在空气中放置变质的原因、胶体的性质,涉及的知识面比较广,综合性加强。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
对下列实验现象的描述错误的是
A.将NaOH溶液加到FeSO4溶液中,生成的沉淀颜色变化:白色→灰绿色→红褐色
B.Cu加到稀H2SO4中,生成无色气体
C.金属Na投入滴有酚酞的水中,得到的溶液颜色变化:无色→红色
D.将NaOH溶液加到AlCl3溶液中,实验现象为:先生成白色沉淀后逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
化学知识在生产、生活中有着广泛的应用。下列说法中不正确的是:
A.用植物秸秆、动物粪便等生产的沼气是一种清洁的能源
B.手机上用的锂离子电池属于二次电池
C.海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
D.研制开发燃料电池汽车,可有效降低机动车尾气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是一种重要的金属资源,工业上制取镁单质主要是电解法。
(1)电解法制取镁单质的反应方程式是:______________________________。
(2)电解原料无水氯化镁可由海水制备。主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶。
其步骤先后顺序是__________________________________;(每步骤可重复使用)
(3)上述步骤①中“一定条件下”具体是指:_______________________________,其目的是___________________________________________。
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0−12,当溶液中c(Mg2+)≤1.0×10−5mol·L−1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥_________________ mol·L−1。
(5)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是___________。反应原理可能有两方面,请分别用离子方程式表示:
①________________________________________________;
②________________________________________________。
要验证①②谁是Mg(OH)2溶解的主要原因,可选取________代替NH4Cl溶液作对照实验。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一。一种“镁—次氯酸盐”电池的总反应为:
Mg + ClO- + H2O == Mg(OH)2 + Cl- 。其工作时正极的电极反应式:_________________;用此镁电池给铅蓄电池充电,下列说法中正确的是______________________________。
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24 g Mg,阴、阳极的质量变化之比为3︰2
D.充电后,镁电池和铅蓄电池的pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是
①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
A.①②④⑤ B.①③④⑤ C.①②③④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,浓度都是1 mol/L的两种气体X2和Y2,在密闭容器中反应生成Z,反应2min后,测得参加反应的X2为0.6mol/L,用Y2变化表示的反应速率v(Y2)= 0.1mol/(L · min),生成的c(Z)= 0.4 mol/L,则该反应方程式为
A.3X2+Y2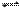 2X3Y B.2X2+Y2
2X3Y B.2X2+Y2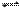 2X2Y
2X2Y
C. X2+2 Y2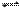 2XY2 D.X2+3Y2
2XY2 D.X2+3Y2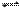 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片和稀硫酸反应 B.Ba(OH)2•8H2O与NH4Cl反应
C.灼热的炭与CO2反应 D.甲烷在O2中燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
①1∶3 ②2∶3 ③1∶7 ④2∶7 ⑤任意比
A. ⑤ B.只有① C.② ④ D.① ③
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
①用25 mL NaOH溶液吸收CO2气体,至CO2气体不再溶解;
②小火煮沸溶液1 min~2 min;
③在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合。此方案能制得较纯净的Na2CO3(第一步的实验装置如下图所示)
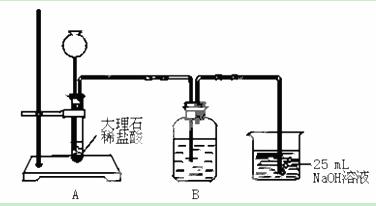
(1)写出①、③两步的化学反应的离子方程式① 。
③
(2)装置B中盛放的试剂是 ,作用是 。
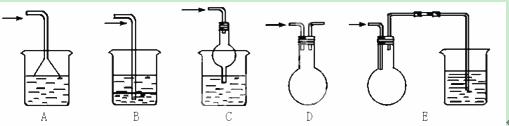
(3)实验室中吸收尾气的方法很多。如下图装置中可以用吸收氨气的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com