
| A. | 甲烷的燃烧热△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 在25℃、101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ•mol-1 |
分析 A.燃烧热中水为液态;
B.物质的量与热量成正比,燃烧为放热反应,焓变为负;
C.合成氨气为可逆反应,而热化学方程式中为完全转化的能量变化;
D.物质的量与热量成正比,且生成硫酸钙放热,中和反应的焓变为负.
解答 解:A.甲烷的燃烧热△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,故A错误;
B.2gH2为1mol,完全燃烧生成液态水,放出285.8 kJ热量,由物质的量与热量成正比可知,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,故B正确;
C.合成氨为可逆反应,由0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ•mol-1,故C错误;
D.HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,物质的量与热量成正比,且生成硫酸钙放热,则H2SO4和Ca(OH)2反应的中和热为△H<2×(-57.3)kJ•mol-1,故D错误;
故选B.
点评 本题考查热化学方程式,为高频考点,把握反应中能量变化、燃烧热与中和热为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.8g | B. | 1.6g | C. | 2.4g | D. | 3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
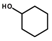 )常用来制取增塑剂和作为工业溶剂.下列说法正确的是( )
)常用来制取增塑剂和作为工业溶剂.下列说法正确的是( )| A. | 环己醇中至少有12个原子共平面 | |
| B. | 与环己醇互为同分异构体,且含有醛基(-CHO)的结构有8种(不含立体结构) | |
| C. | 标准状况下,1mol环己醇与足量Na反应生成22.4LH2 | |
| D. | 环己醇的一氯代物有3种(不含立体结构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Na+、Al3+、SO42-、SiO32- | |
| B. | 碱性溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 0.1mol•L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 与Al反应能放出H2的溶液中:Na+、Fe2+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
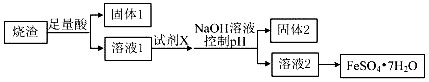
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①③⑥ | C. | ②④⑤ | D. | ①②③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com