
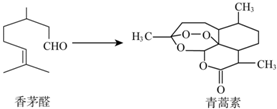
 中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )
中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )| A. | 香茅醛能使Br2的CCl4溶液褪色 | B. | 青蒿素分子式为C15H22O5 | ||
| C. | 青蒿素含有和H2O2相同的过氧键 | D. | 青蒿素能与氢气发生加成反应 |
科目:高中化学 来源: 题型:选择题
 如图是Ca(0H)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )
如图是Ca(0H)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )| A. | a点和b点的Ksp:a<b | |
| B. | 向溶液a中加入CaO并恢复原温度时,溶液的pH不变 | |
| C. | b点时,Ca(OH)2在水中和在NaOH溶液中的溶解度:s(H2O)>s(NaOH) | |
| D. | 溶解速率:b点>a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
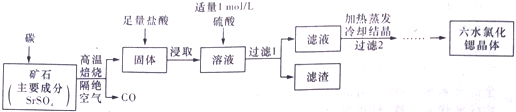
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 位于周期表中同一周期的元素,原子具有相同的电子层数 | |
| B. | 凡是位于周期表中同一主族的元素,原子具有相同的最外层电子数 | |
| C. | 凡是位于周期表中同一周期的元素,都是按从左到右的顺序原子核外最外层电子数由1递增至8 | |
| D. | 凡是位于周期表中同一主族的元素,都是按从上到下的顺序原子核外电子层数逐渐递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热后固体发黑 | B. | 坩埚沾有受热不分解的杂质 | ||
| C. | 加热时有少量晶体溅出 | D. | 晶体中混有受热不分解的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 预测现象 |
| A | 将SO2通入紫色石蕊溶液中 | 石蕊溶液先变红后褪色 |
| B | 将CO2气体通入足量的CaCl2溶液中 | 产生白色沉淀 |
| C | 常温下,将用砂纸打磨过的铝片投入浓硫酸中 | 产生刺激性气体 |
| D | 将酸性高锰酸钾溶液滴入足量的乙醇中 | 高锰酸钾溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
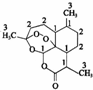 我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )
我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )| A. | 分子式为 C15H2205 | B. | 有较强的还原性,能杀死疟原虫 | ||
| C. | 易溶于水、酒精等溶剂 | D. | 能发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com