
分析 (1)由Ksp可知Ksp[Cu(OH)2]小,易转化为沉淀,氯化铜与氨水反应生成氢氧化铜和氯化铵;
(2)除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,不能引入新杂质;促进铁离子水解转化为沉淀,且不引入新杂质;
(3)由氢氧化铜饱和溶液中溶度积常数计算溶液中的氢离子浓度计算pH;结合氢氧化铁溶度积和残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全.
解答 解:(1)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;
(2)A、C、D均可氧化亚铁离子,但引入新杂质,只有B中还原产物为水,不引入新杂质;调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,C、D均可,A中引入新杂质钠离子,B中引入新杂质铵根离子,且AB中试剂过量导致铜离子转化为沉淀,故答案为:B;AB;
(3)Cu(OH)2的溶度积Ksp=3.0×10-20,溶液中CuSO4的浓度为3.0mol•L-1,c(Cu2+)=3.0mol•L-1;由溶度积常数c(Cu2+)×c2(OH-)=3.0×10-20;c2(OH-)=$\frac{3.0×1{0}^{-20}}{3.0}$=10-20,解得c(OH-)=10-10mol/L,由水溶液中的离子积c(H+)×c(OH-)=10-14,可知c(H+)=10-4mol/L,溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;
残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=8.0×10-38,c(Fe3+)×c3(OH-)=8.0×10-38;c3(OH-)=$\frac{8.0×1{0}^{-38}}{1×1{0}^{-5}}$=8.0×10-33,解得c(OH-)=2×10-11mol/L,由水溶液中的离子积c(H+)×c(OH-)=10-14可知c(H+)=5×10-4mol/L,则pH=3.3,即通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,则方案可行,
故答案为:4;3.3;可行.
点评 本题考查较综合,涉及沉淀的生成、混合物分离提纯及盐类水解应用、溶度积及pH的计算等,注重高频考点的考查,把握反应原理为解答的关键,侧重分析与计算能力的考查,题目难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2,2,4-三甲基-1-丁醇 | D. | 2,3-二乙基-1-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
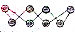 )所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.
)所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以石墨为电极,电解含甲基橙的0.1 mol/L硫酸溶液 | |
| B. | 以铜为电极,电解1 mol/L硫酸溶液 | |
| C. | 以石墨为电极,电解含酚酞的饱和食盐水 | |
| D. | 以石墨为电极,电解1 mol/L溴化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | 离子半径大小:r(M3+)>r(T2-) | |
| C. | X单质在氧气中燃烧生成XO3 | |
| D. | L、X形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 最外层电子数 | 次外层电子数 |
| D | x | x+4 |
| E | x+1 | x+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量之比为1:2:3 | B. | 质子数之比为2:3:6 | ||
| C. | 中子数之比为0:3:4 | D. | 体积之比为6:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com