下列说法正确的是( )
A.25℃时,0.1 mol?L-1pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B.相同温度下,pH相等的Na2CO3溶液、C6H5ONa(苯酚钠)溶液、NaOH溶液:c(C6H5O-)>c(Na2CO3)>c(NaOH)
C.常温下,将CH3COONa溶液、HCl溶液混合所得中性溶液:c(Na+)>c(Cl-)=c(CH3COOH)
D.0.1 mol?L-1Na2CO3溶液与0.1mol?L-1NaHCO3,溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3- )+c(H2CO3)+2c(H+)
【答案】分析:A、溶液显酸性,说明溶液中酸式酸根电离大于水解;
B、盐溶液的碱性是酸根离子水解的原因,酸越弱,对应酸根离子水解程度越大;
C、中性溶液中存在电荷守恒和溶液中的物料守恒分析判断;
D、等物质的量的碳酸钠和碳酸氢钠溶液中电荷守恒和物料守恒计算分析判断.
解答:解:A、25℃时,0.1 mol?L-1pH=4.5的NaHC2O4溶液呈酸性,说明酸式盐电离大于水解,溶液中离子浓度大小为c(HC2O4-)>c(C2O42-)>c(H2C2O4)故A错误;
B、相同温度下,pH相等的Na2CO3溶液、C6H5ONa(苯酚钠)溶液、NaOH溶液中提供相同氢氧根离子浓度,所需要的溶质浓度氢氧化钠最小,Na2CO3溶液水解程度大于C6H5ONa(苯酚钠)溶液,所以溶液浓度Na2CO3溶液<C6H5ONa(苯酚钠)溶液,所以浓度大小为c(C6H5O-)>c(Na2CO3)>c(NaOH),故B正确;
C、将CH3COONa溶液、HCl溶液混合所得中性溶液中的电荷守恒为:[H+]+[Na+]=[OH-]+[CH3COO-]+[Cl-],中性溶液中:[H+]=[OH-],[Na+]=[CH3COO-]+[Cl-],-],醋酸钠溶液中存在[Na+]=[CH3COOH]+[CH3COO-],结合两式可知:c(Na+)>c(Cl-)=c(CH3COOH),故C正确;
D、0.1 mol?L-1Na2CO3溶液与0.1mol?L-1NaHCO3,溶液等体积混合所得溶液中电荷守恒,[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-],物料守恒:3([CO32+-]+[HCO3-]+[H2CO3])=2[Na+],合并消去钠离子得到:c(CO32-)+2c(OH-)=c(HCO3- )+3c(H2CO3)+2c(H+),故D错误;
故选BC.
点评:本题考查了盐类水解的应用,溶液中离子浓度大小的比较,溶液中的电荷守恒,物料守恒的综合应用,正确书写物料守恒和电荷守恒是解题的关键,题目较难.



 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
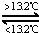 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,