
甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子。 甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是 ( )
甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是 ( )
A.某溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第二周期ⅣA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于溶液和胶体的叙述中不正确的是 ( )
A.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
B.在胶体中加入少量电解质溶液时,可能使胶体发生聚沉
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗 运动
运动
D.溶液中溶质粒子小于1nm,而胶体粒子直径在1nm~100nm之间
查看答案和解析>>
科目:高中化学 来源: 题型:
经测定,某溶液中只含有NH+4、Cl-、H+、OH-四种离子,下列说法中错误的是 ( )
A.溶液中四种离子之问可能满足:c(Cl-)>c(H+)>c(CH+4)>c(OH-)
B.若溶液中的溶质是NH4Cl和NH3·H2O,则离子问可能满足:c(NH+4)>c(Cl-)>c(OH-)>c(H+)
C.若溶液中四种离子满足:c(Cl-)>c(NH+4)>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl
D.若溶液中c(Cl-)=c(NH+4),则该溶液一 定呈中性
定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
将某一元酸HA与NaOH等体积混合,请根据题目要求回答下列问题:
(1)若c(HA)=c(NaOH)=O.lmol/L,测得混合后溶液的pH>7。
①HA是弱电解质,能证明HA是弱电解质的方法是AI3C一。
A测得0. Imol/L HA的pH>l
B.测得NaA溶液的pH>7
C.pH= l的HA与盐酸,稀释10倍后,盐酸的pH变化大
l的HA与盐酸,稀释10倍后,盐酸的pH变化大
D.用足量的锌分别与相同pH、相同体积的盐酸和HA反应,产生氢气一样多
②混合溶液中,关系式一定正确的是BD。
A.c(A-)>c(Na+)c(OH-)>c(H+)
B.c(A-)+c(OH-)一c(Na+)+c(H+)
C.c(HA)+c(A-)一0.1mol/L
D.f( HA) +c( H+)一c(OH-)
③若HA(少量)+B2一 A一+HB-;H2B(少量)+2C- B2-+2HC:
HA+C- A-十HC—
则相同pH的①NaA②Na,B③NaHB④NaC的四种溶液,各物质的物质的量浓度从
大到小的顺序为 (填序号)。
(2)若c( HA) ==c(NaOH)==0.1mol/L,测得混合后溶液的pH=7。
==c(NaOH)==0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA稀释10倍后溶液的pH与该浓度的HA和0.1 mol/L NaOH等体积混合后溶液的pH相等,则HA溶液的浓度为 。
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏大的是 。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.4kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) 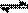 CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
①该反应的△H 0
 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
②在温度容积不变的情况下,向该密闭容器再
增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
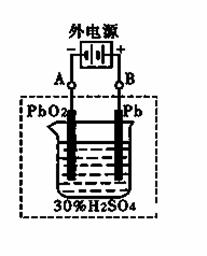 (3)实验室中配制AgNO3溶液时通常需要向其中加入 ,目的是 ; AgCl在水中存在沉淀溶解平衡:
(3)实验室中配制AgNO3溶液时通常需要向其中加入 ,目的是 ; AgCl在水中存在沉淀溶解平衡:
AgCl(s)  Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l00mL 0.2 mol•L-1AgNO3溶液;③100mL 0.1 mol•L-1氯化镁溶液;④100mL 0.1 mol•L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l00mL 0.2 mol•L-1AgNO3溶液;③100mL 0.1 mol•L-1氯化镁溶液;④100mL 0.1 mol•L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com