
| A. | 酸性:H2SO4<H3PO4 | B. | 非金属性:Cl>Br | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 稳定性:HF>HCl |
分析 A.非金属性越强,对应最高价含氧酸的酸性越强;
B.同主族从上到下非金属性减弱;
C.金属性越强,对应碱的碱性越强;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.非金属性S>P,则对应最高价含氧酸的酸性为H2SO4>H3PO4,故A错误;
B.同主族从上到下非金属性减弱,则非金属性:Cl>Br,故B正确;
C.金属性Na>Mg,对应碱的碱性为NaOH>Mg(OH)2,故C正确;
D.非金属性F>Cl,对应氢化物的稳定性为HF>HCl,故D正确;
故选A.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | 只有④ | C. | 只有③ | D. | 只有① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
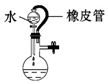 | 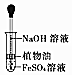 | 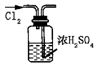 |  |
| A.证明该装置气密性良好 | B.观察Fe(OH)2的生成 | C.干燥Cl2 | D.比较Na2CO3与NaHCO3的稳定性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6 gNa与O2完全反应,生成7g产物时失去电子的物质的量为0.2 mol | |
| B. | Na与稀硫酸反应的离子方程式为2Na+2H+=2Na++H2↑ | |
| C. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 | |
| D. | 金属钠着火可以用泡沫灭火器或用干燥的沙土灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去NaCl溶液中少量CaCl2:加入适量Na2CO3,过滤 | |
| B. | 用四氯化碳可以从碘水中萃取碘 | |
| C. | Na2CO3固体中含有少量NaHCO3杂质可用加热的方法提纯 | |
| D. | 既可用品红溶液或酸性KMnO4溶液鉴别 CO2和SO2,也可用澄清石灰水鉴别 CO2和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com