
在一定温度下的定容密闭容器中,当下列物理量不再随时间变化时,表明反应:
A (s)+2B (g)  C (g)+D (g)一定已达到平衡状态的是:
C (g)+D (g)一定已达到平衡状态的是:
A.混合气体的压强 B.混合气体的密度
C.混合气体的物质的量 D.混合气体中C和D的物质的量比
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g);ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
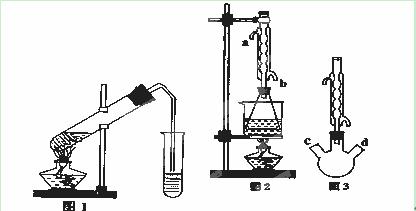
Ⅰ(本题9分)乙酸乙酯是重要的工业原料和溶剂,通常混有少许乙醇和乙酸。某学习小组利用图1装置制取乙酸乙酯粗产品,再分析乙酸乙酯的含量。
| 乙酸乙酯 | 乙醇 | 乙酸 | |
| 沸点 | 77.1℃ | 78.5℃ | 117.9℃ |
操作步骤如下:
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol·L—1NaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为40.0mL
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL 2.1mol·L—1NaOH溶液混合均匀后,装上冷凝箱,在水浴上加热回流约1小时,装置如图2所示。待冷却后,用0.50mol·L—1HCl滴定过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答下列问题:
(1)实验(II)中冷水从冷水凝管的 (填a或b)管口通入。
(2)利用实验(I)、(II)测量的数据计算粗产物中乙酸乙酯的质量分数为 。
(3)实验结束后,同学们对粗产品中乙酸乙酯的含量不高进行讨论。
①有人认为是实验(II)带来的误差。建议将图2中的锥形瓶改为三颈瓶,装置如图3,在三颈瓶的c、d口装配相关的仪器并进行恰当的操作,可以提高测定的精确度。你认为在三颈瓶的c、d口装配相关的仪器或操作是: (填字母);
A.装上温度计,严格控制反应温度
B.实验中经常打开瓶口,用玻璃进行搅拌
C.在反应后期,用事先安装的分液漏斗添加一定量的NaOH溶液
②还有同学认为改进乙酸乙酯的制取装置(图1)才能提高产率。拟出你的一条改进建议
Ⅱ(本题6分)如图是配制50 mL酸性KMnO4标准溶液的过程示意图。
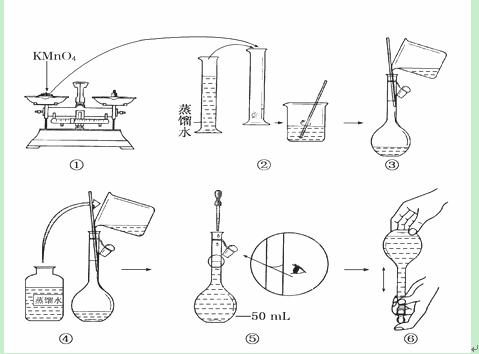
(1)请你观察图示判断其中不正确的操作有________(填序号)。
(2)其中确定50 mL溶液体积的容器是____________________________________(填名称)。
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
维生素C主要存在于蔬菜、水果中,它能增加人体对疾病的抵抗能力。其结构简式如右图,请回答:
(1)维生素C的分子式是 ,其中饱和碳原子个数为 ;其分子中不含氧的官能团的名称是 。
(2)维生素C可发生的化学反应有 (填序号)。
 ① 加成反应 ② 氧化反应 ③ 酯化反应
① 加成反应 ② 氧化反应 ③ 酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列四个图像的说法中正确的是

A.图①表示可逆反应 “CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH小于0
CO2(g)+H2(g)”中的ΔH小于0
B.图②是在长时间电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定
为1︰1
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH大于0
2AB3(g)”的ΔH大于0
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知两种弱酸的酸性:HA>HB,在常温下下列各项比较中正确的是
A.等物质的量浓度的HA溶液与NaB溶液等体积的混合液中:
2c(Na+) =c(A-)+c(B-)+c(HA)+c(HB)
B.pH相等的NaA与KB两溶液中:[c(Na+)-c(A-)] < [c(K+)-c(B-)]
C.pH=9的三种溶液 ①NaB ②NH3·H2O ③NaOH中由水电离出的c(OH-):①>②>③
D. 两种溶液① 0.1mol/L HA溶液 ②0.1mol/L HB溶液,加水稀释至pH 相同,需加水的量前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A、1.0L 1.0mol·L-1CH3COOH溶液中,CH3COOH分子数为6.02×1023
B、 Na与H2O反应生成1.12L H2(标准状况),反应中转移的电子数为6.02×1023
C、32 g S8单质中含有的S—S键个数为6.02×1023 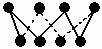
D、22.4 L N2中所含的分子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法不正确的是
A.气态氢化物的稳定性:HX>H2Y>ZH3 B.非金属活泼性:Z<Y<X
C.单质的氧化性:X2>Y>Z D.原子最外电子层上的电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com