
 图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,打开K,接通电路后,发现B 上的 C 点显红色,请填空:
图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,打开K,接通电路后,发现B 上的 C 点显红色,请填空:
| ||
| ||


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、白磷和红磷 |
| B、CH3CH2CH3和CH3CH2CH2CH3 |
| C、CH3CH(CH3)CH2CH3和CH3CH2CH(CH3)CH3 |
| D、CH3CH(CH3)CH2CH3和CH3CH2CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若起始时加入容器的只有反应物X、Y,则起始加入的X、Y的物质的量之比一定是2:3 |
| B、若起始时加入容器的有X、Y、Z,则起始时加入的X、Y的物质的量之比一定是2:3,而Z的物质的量一定小于1.2mol |
| C、达到平衡状态时,Z的浓度可能是0.1mol/L也可能是0.6mol/L |
| D、达到平衡状态时,X的浓度可能是0.1mol/L也可能是0.4moL/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体中可能有乙烷 |
| B、混合气体一定是甲烷和乙烯 |
| C、混合气体中一定有甲烷 |
| D、混合气体中一定有乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
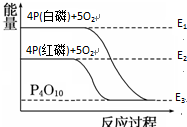
| A、白磷比红磷稳定 |
| B、白磷燃烧是吸热反应 |
| C、红磷转变为白磷是吸热反应 |
| D、红磷燃烧的热化学方程式:4P(s)+5O2(g)=P4O10(s)△H=(E2-E3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com