
分析 稀释过程中钠离子的物质的量不变,据此计算出稀释后溶液中钠离子的浓度,然后根据硫酸钠为中性可知c(OH-)=10-7mol/L,据此进行计算.
解答 解:25℃时,某Na2SO4溶液中cc(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L,但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1,
故答案为:1000:1.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确稀释过程中溶质的物质的量不变为解答关键,注意掌握物质的量浓度的表达式及应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
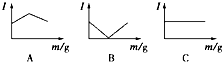 在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.| A | B | C | |
| A | ① | ② | ③ |
| B | ④ | ②③ | ① |
| C | ③ | ①② | ④ |
| D | ② | ①③ | ④ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) | |
| B. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 | |
| D. | 不同pH的溶液中有:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.
已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2为还原产物 | |
| B. | 当x=2时,每生成1 mol N2,转移电子数为4 mol | |
| C. | 等物质的量N2和CO2中,共价键的个数比为3:4 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
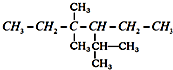 系统命名:2,4,4-三甲基-3-乙基己烷.
系统命名:2,4,4-三甲基-3-乙基己烷. 的系统名称3-甲基-2-乙基-1-丁烯,将其在催化剂存在下完全氢化所得烷烃的系统名称是2,3-二甲基戊烷.
的系统名称3-甲基-2-乙基-1-丁烯,将其在催化剂存在下完全氢化所得烷烃的系统名称是2,3-二甲基戊烷.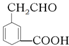 碳碳双键、醛基、羧基.
碳碳双键、醛基、羧基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和环丙烷 | B. | 甲烷和乙烷 | C. | 丙烯和丙烷 | D. | 丙烷和环丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Cl2通入氯化亚铁溶液:Fe2++Cl2═Fe3++2Cl- | |
| B. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向硝酸亚铁溶液中加入稀硫酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 往水玻璃中通入少量二氧化碳:SiO32-+H2O+CO2═H2SiO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com