
| A. | pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液:c(NH4+)大小顺序为①>②>③ | |
| B. | 0.2mol•L-1CH3COOH溶液和0.2mol•L-1CH3COONa溶液等体积混合:c(CH3COOH)+c(CH3COO-)=2c(Na+) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 0.1mol•L-1NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
分析 A、从两个角度考虑,一是相同pH的(NH4)2SO4与NH4Cl溶液的水解程度是否相等,二是NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,以此来解答;
B、物质的量浓度各为0.2mol•L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液为原来的体积的2倍,则有:c(CH3COOH)+c(CH3COO-)=0.2mol/L,而c(Na+)=0.1mol•L-1,由此分析解答;
C、根据电荷守恒分析解答;
D、0.1mol•L-1NaHA溶液,其pH=4,说明溶液呈酸性,即电离大于水解,由此分析解答.
解答 解:A、相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,所以c(NH4+)大小顺序为①=②>③,故A错误;
B、物质的量浓度各为0.2mol•L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液为原来的体积的2倍,则有:c(CH3COOH)+c(CH3COO-)=0.2mol/L,而c(Na+)=0.1mol•L-1,所以c(CH3COOH)+c(CH3COO-)=2c(Na+),故B正确;
C、NaHCO3溶液中由电荷守恒可知:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C错误;
D、0.1mol•L-1NaHA溶液,其pH=4,说明溶液呈酸性,即电离大于水解,所以离子浓度大小为:c(HA-)>c(H+)>c(A2-)>c(H2A),故D错误;
故选B.
点评 本题考查离子浓度大小的比较,为高频考点,把握pH=4的NaHA溶液,电离程度大于水解程度解答的关键,侧重分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
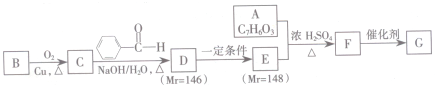
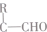
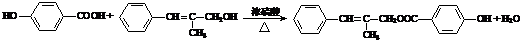 .
. .
.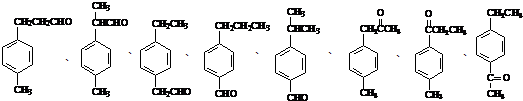 (其中任一种).
(其中任一种).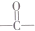 结构②苯环上有2个取代基.
结构②苯环上有2个取代基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
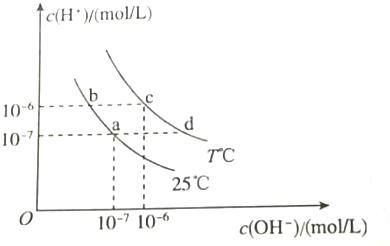
| A. | a点对应的溶液中:Al3+、Na+、Cl-、CO32- | |
| B. | b点对应的溶液中:K+、Ba2+、NO3-、AlO2- | |
| C. | c点对应的溶液中:Fe3+、Na+、I-、SO42- | |
| D. | d点对应的溶液中:Na+、K+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三角锥形、sp3 | B. | V形、sp2 | C. | 平面三角形、sp2 | D. | 三角锥形、sp2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
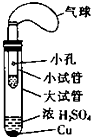 某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4.回答下列问题:
某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com