

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
分析 含钴废料中加入盐酸,加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl2•6H2O晶体,应控制温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干.
(1)根据流程图结合信息浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等进行解答;
(2)NaClO3的作用是将Fe2+氧化成Fe3+;
(3)加Na2CO3的目的是除去三价铁离子和铝离子,但不能除去Co2+,根据铝离子、铁离子完全沉淀的PH和Co2+开始沉淀的PH值进行解答;
(4)气压越低,液体沸点越低,烘干所需温度越低,可防止CoCl2•6H2O分解;
(5)制取CoCl2•6H20必须除去溶液中的Mn2+,向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;
由图象可知,调节溶液PH在3.0~3.5之间,可萃取出溶液中的Mn2+,并让Co2+大量存在于溶液中;
(6)根据从溶液中制取固体的方法制取氯化钴固体,从而确定操作步骤;
(7)由电子守恒:Cl2~2e-~2Co3+,则n(Co3+)=2n(Cl2)=2×$\frac{0.448L}{22.4L/mol}$=0.04mol,n(Co原子)总=n(Co2+)溶液=$\frac{13g}{130g/mol}$=0.1mol,
所以固体中的n(Co2+)=0.1mol-0.04mol=0.06 mol,根据化合价为0,计算氧的物质的量,再得出y:x的值.
解答 解:(1)向水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等],加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,所以Co(OH)3和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应的离子方程式为:2Co(OH)3+SO32-+4H+=2Co2++SO42-+5H2O,
故答案为:2Co(OH)3+SO32-+4H+=2Co2++SO42-+5H2O;
(2)NaClO3的作用是将Fe2+氧化成Fe3+,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)加Na2CO3的目的是除去三价铁离子和铝离子,但不能除去Co2+,铝离子、铁离子完全沉淀的PH是5.2,Co2+开始沉淀的PH是7.6,则选择PH的范围是:5.2≤PH<7.6,
故答案为:5.2≤PH<7.6;
(4)温度高时,CoCl2•6H2O易分解,而气压越低,液体沸点越低,烘干所需温度越低,减压烘干的原因在于可防止CoCl2•6H2O分解,
故答案为:降低烘干温度,防止产品分解;
(5)制取CoCl2•6H20必须除去溶液中的Mn2+,向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+,
由图象可知,调节溶液PH在3.0~3.5之间,可萃取出溶液中的Mn2+,并让Co2+大量存在于溶液中,
故答案为:除去溶液中的Mn2+;B;
(6)利用从溶液中制取固体的方法制取氯化钴固体,其操作步骤为:蒸发浓缩、冷却结晶和过滤,
故答案为:冷却结晶、过滤;
(7)由电子守恒:Cl2~2e-~2Co3+,则n(Co3+)=2n(Cl2)=2×$\frac{0.448L}{22.4L/mol}$=0.04mol,n(Co原子)总=n(Co2+)溶液=$\frac{13g}{130g/mol}$=0.1mol,
所以固体中的n(Co2+)=0.1mol-0.04mol=0.06 mol,
根据化合价为0,氧化物中n(O)=(0.06mol×2+0.04mol×3)÷2=0.12mol,
故该钴氧化物中n(O):n(Co)=0.12mol:0.1mol=6:5,
故答案为:6:5.
点评 本题通过制取CoCl2•6H2O的工艺流程,考查了物质制备方案的设计,题目难度中等,理解工艺流程图、明确实验操作与设计及相关物质的性质是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
 水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:
水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0g D218O中含有的质子数为NA | |
| B. | 标准状况下,22.4L NH3分子含有的杂化轨道数为4NA | |
| C. | 78g Na2O2晶体中所含阴、阳离子个数均为2NA | |
| D. | 1mol Fe完全溶于一定量的硝酸溶液中,转移的电子数一定是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 结构简式 | 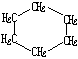 | 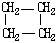 | Br-CH2-CH2-CH(CH3)-CH2-Br |
| 键线式 | 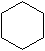 (环己烷) (环己烷) |  (环丁烷) (环丁烷) |  |

 (不需注明反应条件)
(不需注明反应条件)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com