

分析 (1)依据装置图2的实验目的是升华碘单质提纯,烧瓶是冷凝升华的碘单质,防止扩散到烧杯外;
(2)配置200ml2mol•L-1的H2SO4,需要量取含溶质H2SO4的物质的量为:0.2L×2mol/L=0.4mol溶液加水配制成200ml溶液;
A.二氧化硫溶于水只能生成亚硫酸;
B.向100ml4mol•L-1的H2SO4中加入100ml水,溶液体积不是200ml;
C.取5mol•L-1的H2SO480.0ml,溶质物质的量=5mol•L-1×0.080L=0.4mol,加水至200ml,溶液浓度=$\frac{0.4mol}{0.2mol}$=2mol/L;
D.将16gNaOH物质的量=$\frac{16g}{40g/mol}$=0.4mol,固体加入到5ml2mol/LH2SO4溶液中,发生反应2NaOH+H2SO4=Na2SO4+2H2O溶液中剩余硫酸溶质和生成的硫酸钠溶质,不能配制200ml2mol•L-1的H2SO4;
(3)依据Fe3+水解容易生成氢氧化铁使溶液变浑浊分析;
(4)由反应①、②可得出如下关系式:6I-~Cr2O72-,滴定消耗标准液K2Cr2O7溶液的体积=19.60 mL,则:c(I-)×0.025 0 L=6×0.0250 mol•L-1×0.01960 L,解得c(I-)=0.1176 mol•L-1,则计算得到废液中I-的含量;
(5)CuI中Cu+和I-均可被浓HNO3氧化,根据得失电子守恒、原子守恒可写出:
(6)图2是利用升华法提纯碘,冷凝水应从a口进,使碘蒸气更易凝结为固体碘.
解答 解:(1)依据装置图2的实验目的是升华碘单质提纯,烧瓶是冷凝升华的碘单质,防止扩散到烧杯外;
故答案为':冷凝升华的碘单质,防止扩散到烧杯外;
(2)溶液配制的步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,在烧杯中溶解,冷却后转移到250ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加到刻度,配置200ml2mol•L-1的H2SO4,需要量取
A.在200ml1mol•L-1的H2SO4中加入22.4L标准状况下的SO2 ,二氧化硫溶于水只能生成亚硫酸,故A错误;
B.向100ml4mol•L-1的H2SO4中加入100ml水,溶液体积不是200ml,故B错误;
C.取5mol•L-1的H2SO480.0ml,溶质物质的量=5mol•L-1×0.080L=0.4mol,加水至200ml,溶液浓度=$\frac{0.4mol}{0.2mol}$=2mol/L,故C正确;
D.将16gNaOH物质的量=$\frac{16g}{40g/mol}$=0.4mol,固体加入到5ml2mol/LH2SO4溶液中,硫酸物质的量=0.005ml×2mol/L=0.01mol,2NaOH+H2SO4=Na2SO4+2H2O溶液中剩余硫酸溶质和生成的硫酸钠溶质,不能配制200ml2mol•L-1的H2SO4,故D错误;
故答案为:C;
(3)在盛有废液的锥形瓶中先加入5ml2mol/LH2SO4的目的是为了抑制Fe3+的水解,故答案为:为了抑制Fe3+的水解;
(4)由反应①、②可得出如下关系式:6I-~Cr2O72-,滴定消耗标准液K2Cr2O7溶液的体积V=19.60 mL,则c(I-)×0.025 0 L=6×0.0250 mol•L-1×0.01960 L,
解得c(I-)=0.1176 mol•L-1,
则废液中I-的含量为0.1176mol•L-1×127 g•mol-1≈14.94 g•L-1;
故答案为:14.94;
(5)CuI中Cu+和I-均可被浓HNO3氧化,根据得失电子守恒、原子守恒可写出:2CuI+8HNO3=2Cu(NO3)2+4NO2↑+I2+4H2O;
故答案为:2CuI+8HNO3=2Cu(NO3)2+4NO2↑+I2+4H2O;
(6)图2是利用升华法提纯碘,冷凝水应从a口进,使碘蒸气更易凝结为固体碘,故答案为:升华法;a.
点评 本题以物质的制备为载体考查了氧化还原反应、离子的检验、物质的分离和提纯,明确物质的性质是解本题关键,根据物质的特殊性质、混合物分离和提纯方法的选取等方面来分析解答,知道碘的检验方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
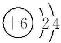 B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的KSp=6.82×10-6mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| B. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 | |
| C. | 将表中三种物质分别与水混合,分别加热、灼烧,最终的固体产物相同 | |
| D. | 用足量石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸乙酯和水、酒精和水、植物油和水 | |
| B. | 四氯化碳和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙酸和乙醇、乙酸和水 | |
| D. | 水和植物油、己烷和水、苯和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
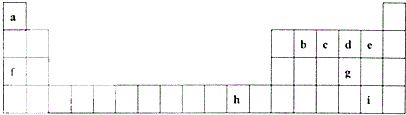 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.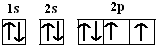 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
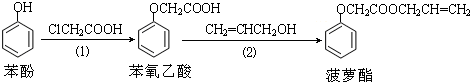
| A. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| C. | 苯酚和菠萝酯均可与溴水发生反应 | |
| D. | 步骤(2)产物中残留的烯丙醇可用溴水检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
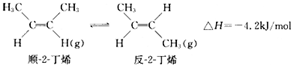
| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 加压和降温都有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯不能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com