
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,25℃,101kPa时呈气态,它清洁、高效、具有优良的环保性能。92g气态二甲醚25℃,101kPa时燃烧放热2910kJ。
(1)写出二甲醚燃烧热的热化学方程式_______________________________________________;当燃烧放出582kJ热量时,转移的电子数为_______________。
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mo;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为______________________________;
(3)工业上利用H2和CO2合成二甲醚的反应如下:
6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是______________________________(选填字母编号)
A. c(H2)与c(H2O)的比值保持不变
B.单位时间内有2mol H2消耗时有1mol H2O生成
C.容器中气体密度不再改变
D.容器中气体压强不再改变
E.反应产生的热量不再变化
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产量将_______________(填“变大”、“变小”或“不变”,下同),混合气体的平均摩尔质量将_______________。
【答案】 CH3-O-CH3(g) +3O2(g)→2CO2(g)+3H20 (l) ΔH=-1455KJ/mol 4.8NA -378.8KJ/mol ADE 变小 变小
【解析】(1)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,92g气态二甲醚的物质的量是2mol,25℃,101kPa时燃烧放热2910kJ,因此甲醚的燃烧热为1455 kJ/mol,则二甲醚燃烧的热化学方程式为CH3OCH3(g)+ 3O2(g)= 2CO2(g)+ 3H2O(l)△H =﹣1455 kJ/mol;当燃烧放出582kJ热量时,消耗二甲醚是582kJ÷1455 kJ/mol=0.4mol。根据方程式可判断1mol二甲醚反应消耗3mol氧气,转移12mol电子,因此反应中转移的电子数为4.8NA;(2)已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1,则有关的热化学方程式为:①H2(g)+ 1/2O2(g)=H2O(l)△H=-285.8 kJ/mol;②C(s)+ O2(g)=CO2(g)△H=-393.5 kJ/mol;③CH3OCH3(g)+ 3O2(g)=2CO2(g)+ 3H2O(l)△H=-1455 kJ/mol,所以根据盖斯定律可知①×3 + ②×2-③得到反应热化学方程式为:2C(s)+ 3H2(g)+ 1/2O2(g)=CH3OCH3(g) △H=-169.4 kJ/mol,即4C(s)+ 6H2(g)+ O2(g)=2CH3OCH3(g) △H=-378.8 kJ/mol。(3)①在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A、氢气是反应物,水蒸气是生成物,因此当c(H2)与c(H2O)的比值保持不变时可以说明反应达到平衡状态,A正确;b、根据方程式可知单位时间内有2mol H2消耗时一定有1mol H2O生成,因此不能据此说明达到平衡状态,B错误;C、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器中气体密度不再改变不能说明达到平衡状态,C错误;D、正方应是压强减小的可逆反应,因此当容器中气体压强不再改变是能说明达到平衡状态,D正确;E.反应产生的热量不再变化说明正逆反应速率相等,达到了化学平衡状态,E正确,答案选ADE;②正方应是放热反应,因此温度升高,该化学平衡向逆反应方向移动,到达新的平衡,CH3OCH3的产率将变小。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,物质的量增大,则混合气体的平均式量将变小。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I.请用离子方程式来解释下列事实,必要时可加一定文字说明:
(1)泡沫灭火器的化学原理________________________________________________。
(2)热的纯碱溶液清洗油污___________________________________________。
(3)亚硫酸氢钠的水溶液显酸性________________________________________________。
(4)若强碱AOH与弱酸形成的盐AmB为强碱弱酸盐,其主要的水解方程式为_______________________________________________________。
II. 某温度下,纯水的pH=6,则该温度下
(5)pH=7的CH3COONa溶液与 pH=8的氨水溶液中,由水电离出的c(H+)之比为_______________________。
(6)该温度下,pH=7的CH3COONa溶液中,c(Na+)-c(CH3COO-)=______________(写出精确数值)。
Ⅲ.在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显____________性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g) ![]() 2Z(g)ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是
2Z(g)ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是
A.10min内,Y的平均反应速率为0.03 mol·Lˉ1·sˉ1
B.第10min时,X的反应速率为0.01 mol·Lˉ1·minˉ1
C.10min内,消耗0.2 mol X,生成0.4 mol Z
D.10min内,X和Y反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连。若a、d相连,a为负极;c、d相连,c极产生大量气泡;b、c相连,b为正极;则这四种金属中金属性最强的是( )
A. a B. b C. c D. d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的化工原料。下列有关苯乙烯的说法错误的是( )
A.能与溴水发生加成反应
B.能使酸性高锰酸钾溶液褪色
C.与氯化氢反应可以生成氯代苯乙烯
D.在催化剂存在下可以制得聚苯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)氧化还原反应的本质是 , 通常可用元素化合价的升降来判断氧化剂、还原剂.所含元素化合价升高的物质是剂,发生反应.
(2)写出用稀氢氧化钠吸收氯气反应的离子方程式:
(3)0.1mol/L的Na2CO3溶液的含义是(填字母)
A.1L水中含有0.1mol Na2CO3
B.1L溶液中含有10.6g Na2CO3
C.将10.6g Na2CO3溶于1L水配成的溶液
D.1L溶液中含有0.2mol Na+
(4)关于钠及其化合物的叙述正确的是(填字母)
A.钠元素在自然界中都是以化合态存在
B.钠着火时可以用湿布盖灭
C.实验室少量的钠应保存在煤油或石蜡油中
D.实验中剩余的过氧化钠粉末可以用纸包裹好后,放入垃圾桶内
(5)下列反应的离子方程式书写不正确的是(填字母)
A.氯化钙溶液与碳酸钠溶液反应:Ca2++CO32﹣=CaCO3↓
B.氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42﹣=BaSO4↓
C.氢氧化镁与稀盐酸反应:Mg(OH)2+2H+=Mg2++2H2O
D.氢氧化钡溶液与盐酸的反应:OH﹣+H+=H2O
E.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
F.碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为
A. 56m/V mol·L-1 B. 3m/56V mol·L-1
C. m/56V mol·L-1 D. 3m/112V mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些烷烃的燃烧热如下表:
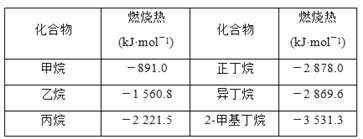
下列说法正确的是( )
A. 正戊烷的燃烧热大约是-3 540 kJ·mol-1
B. 热稳定性:正丁烷>异丁烷
C. 乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ·mol-1
D. 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于取代反应的是
A.苯与浓硫酸、浓硝酸共热制取硝基苯
B.乙炔与溴的四氯化碳溶液反应
C.甲烷和氯气反应生成一氯甲烷
D.溴乙烷与氢氧化钠的水溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com