
【题目】工业生产硫酸接触室发生如下化学反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ·mol-1。一定温度下,向甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示,下列判断中,正确的是( )
2SO3(g) ΔH=-196.6kJ·mol-1。一定温度下,向甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示,下列判断中,正确的是( )
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.6 | 1.2 | 1.2 |
n(O2)/mol | 0.36 | 0.36 | 0.72 | |
SO2的平衡转化率 | 80% | α1 | α2 | |
A.甲→乙,平衡向正反应方向移动,α(O2)增大,放出的热量为47.18kJ
B.平衡时,丙中c(SO2)是甲中的2倍
C.平衡时,SO2的转化率:α2>80%>α1
D.该温度下,平衡常数K=400
【答案】C
【解析】
A、乙相对于甲,SO2浓度增加,平衡正向移动,O2转化率增加,
甲容器中: 2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始(mol) 0.6 0.36 0
转化(mol) 0.48 0.24 0.48
平衡(mol) 0.12 0.12 0.48
其放出的热量= ![]() =47.18kJ,由甲→乙,因氧气浓度降低了,增加的0.6molSO2转化将会降低,其放出的热量一定小于47.18kJ,故A错误;
=47.18kJ,由甲→乙,因氧气浓度降低了,增加的0.6molSO2转化将会降低,其放出的热量一定小于47.18kJ,故A错误;
B、丙相对于甲,反应物浓度增加一倍,相当于增大一倍压强,平衡正向移动,平衡时丙中c(SO2)小于甲中2c(SO2),故B错误;
C、由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,二氧化硫转化率减小,乙、丙可知二氧化硫浓度相同,氧气浓度增大,二氧化硫转化率增大,则平衡时,SO2的转化率:α1<80%<α2,故C正确;
D、甲容器中:2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始(mol/L) 0.3 0.18 0
转化(mol/L) 0.24 0.12 0.24
平衡(mol/L) 0.06 0.06 0.24
K=![]() =
=![]() ,故D错误。
,故D错误。


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】下表是甲、乙、丙、丁、戊五种有机物的有关信息:
甲 | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
乙 | ①由C、H两种元素组成;②球棍模型为 |
丙 | ①由C、H、O三种元素组成;②能与Na反应,但不能与 |
丁 | ①相对分子质量比丙少;②能由丙氧化而成 |
戊 | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应所得产物的名称是___________________。
(2)甲与氢气发生加成反应后生成物质己,在己在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式![]() 。当n=___________________时,这类有机物开始出现同分异构体。
。当n=___________________时,这类有机物开始出现同分异构体。
(3)乙具有的性质是___________________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性![]() 溶液和溴水反应而使其褪色
溶液和溴水反应而使其褪色
(4)丙与戊反应能生成相对分子质量为100的酯,所发生反应的反应类型为_____________________,对应的化学方程式为_______________________。
(5)写出丙氧化生成丁的化学反应方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意完成下列问题。
(1)将等质量的锌粉分别投入10 mL 0.1 mol·L-1盐酸和10 mL 0.1 mol·L-1 CH3COOH溶液中。若锌不足量,反应快的是________(填写盐酸溶液、醋酸溶液)。
(2)将等量的锌粉分别投入c(H+)均为1 mol·L-1、体积均为10 mL的盐酸和醋酸溶液中。若锌不足量,反应快的是________(填写盐酸溶液、醋酸溶液)。
(3)设水的电离平衡线如图所示。

a.若以A点表示25°时水在电离平衡时的粒子浓度,当温度升高到100°时,水的电离平衡状态到B点,则此时水的离子积增加到____________;
b.将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持在100°的恒温,欲使混合溶液的pH=7,则Ba(OH) 2溶液和盐酸的体积比为___________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合溶液pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol/L (填准确数值)。
(5)已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。下列对该溶液的叙述正确的是________________。
A.该温度高于25 ℃
B.由水电离出来的H+的浓度为1×10-10 mol·L-1
C.取该溶液加水稀释100倍,溶液中的水电离出的c(H+)减小
D.加入NaHSO4晶体抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式的为( )
A.向FeI2溶液中通入少量的氯气:Cl2+2Fe2+=2Fe3++2Cl-
B.光导纤维遇碱性土壤“短路”:SiO2+2OH-=SiO32-+H2O
C.电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.向明矾溶液中加入Ba(OH)2使Al3+刚好沉淀完全:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下表:
化学键 | O=O | H—H | H—O(g) |
1 mol化学键断裂时 需要吸收的能量/kJ | 496 | x | 463 |
则表中x为( )
A.920B.557C.436D.188
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、_________________、_______
(2)实验时大烧杯上若不加盖板,求得中和热![]() 的数值__________
的数值__________![]() 填“偏大”“偏小”或“无影响”
填“偏大”“偏小”或“无影响”![]() 。
。
(3)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如右表所示。
![]() 设充分反应后溶液的比热容
设充分反应后溶液的比热容![]() ,忽略实验仪器的比热容及溶液体积的变化,则
,忽略实验仪器的比热容及溶液体积的变化,则![]() ____________________;
____________________;![]() ____________________。
____________________。![]() 已知溶液密度均为
已知溶液密度均为![]()
![]() 原因是_____________________________________________________________。
原因是_____________________________________________________________。
反应物 | 起始温度 | 终了温度 | 中和热 |
A. |
|
|
|
B. |
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某香料F的合成路径如图所示![]() 部分产物略去
部分产物略去![]() 。
。
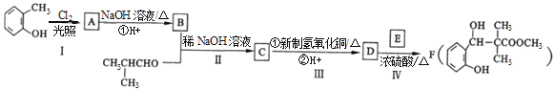
已知:①同一个碳原子上连接有两个羟基时不稳定,会自动脱水
②![]()
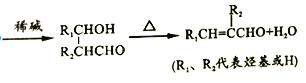
请回答下列问题:
![]()
![]() 的系统命名为______;A的结构简式为___________。
的系统命名为______;A的结构简式为___________。
![]() 含有的官能团名称是 ______________。
含有的官能团名称是 ______________。
![]() 写出步骤III第①步反应的化学方程式_____________;反应Ⅱ的反应类型为_____。
写出步骤III第①步反应的化学方程式_____________;反应Ⅱ的反应类型为_____。
![]() 在引发剂作用下,D可以缩聚合成高聚物,其化学方程式____________________。
在引发剂作用下,D可以缩聚合成高聚物,其化学方程式____________________。
![]() 物质G的化学式为
物质G的化学式为![]() ,同时满足下列条件的G的同分异构体有_____
,同时满足下列条件的G的同分异构体有_____![]() 写结构简式
写结构简式![]() 。
。
①核磁共振氢谱显示苯环上有四种不同的氢
②常温下,能与![]() 溶液反应产生气体
溶液反应产生气体
③遇氯化铁溶液会显色
![]() 结合上述合成方法,以乙醇为原料,无机试剂任选,设计合成聚
结合上述合成方法,以乙醇为原料,无机试剂任选,设计合成聚![]() 丁烯醛
丁烯醛![]() 的线路图:__________________________________________________。合成路线示例如下:CH2=CH2
的线路图:__________________________________________________。合成路线示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应:4NO2(g)+O2(g)![]() 2N2O5(g) ΔH<0,T1时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如表所示。
2N2O5(g) ΔH<0,T1时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如表所示。
时间/s | 0 | 5 | 10 | 15 |
c(NO2)/(mol·L-1) | 4.00 | 2.52 | 2.00 | c3 |
c(O2)/(mol·L-1) | 1.00 | c1 | c2 | 0.50 |
(1)0~10s内N2O5的平均反应速率为__ ,此温度下的平衡常数为___。
(2)其他条件不变,将容器体积压缩一半,则重新达到平衡时c(N2O5)___2.00mol·L-1(填“>、<或=”,下同)
(3)假设温度T1时平衡常数为K1,温度T2时平衡常数为K2,若K1<K2,则T1____T2。
(4)下列可以作为平衡的依据的是___
A.容器内混合气体的颜色不再改变
B.生成1molO2的同时消耗2molN2O5
C.混合气体的平均摩尔质量不再变化
D.混合气体的密度不再变化
(5)改变哪些措施可以增加NO2的平衡转化率___(答出任意两条及以上)
(6)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol1
2C(s)+O2(g)=2CO(g) ΔH=﹣221.0 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=﹣393.5 kJ·mol1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=___ kJ·mol1,利于该反应自发进行的条件是___(选填“高温”或“低温”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表示确的是
A. 原子结构示意图 只能表示12C原子
只能表示12C原子
B. 黄钾铁矾[KFe3(SO4)2(OH)6]中,Fe的化合价为+2
C. ![]() 系统命名法为3-丁烯
系统命名法为3-丁烯
D. 甲基的电子式为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com